Хирургическое лечение эпилепсии, вызванной дисгенезиями коры головного мозга
Ситников А. Р., Григорян Ю. А., Мишнякова Л. П., Вербицкая Г.О.
Ключевые слова: эпилепсия, фокальная корковая дисплазия, гетеротопия серого вещества, кортикография
Цель: оценка результатов хирургического лечения эпилепсии у пациентов с нарушениями миграции нейронов коры головного мозга.
Материалы и методы: оперировано 4 пациента в возрасте от 20 до 37 лет (2 мужчин и 2 женщины) с эпилепсией, вызванной различными нарушениями развития коры головного мозга.
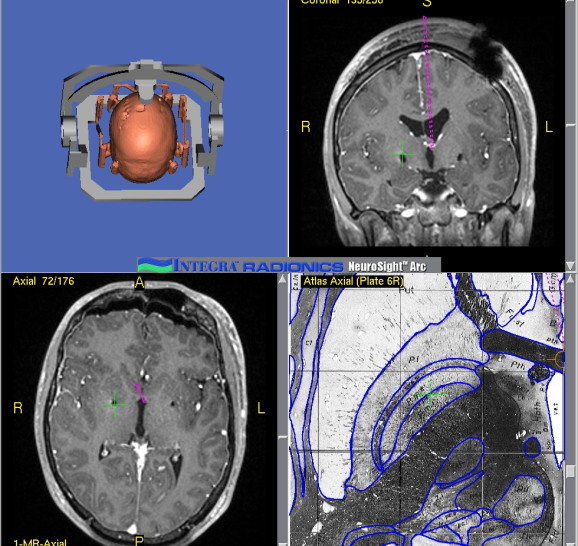
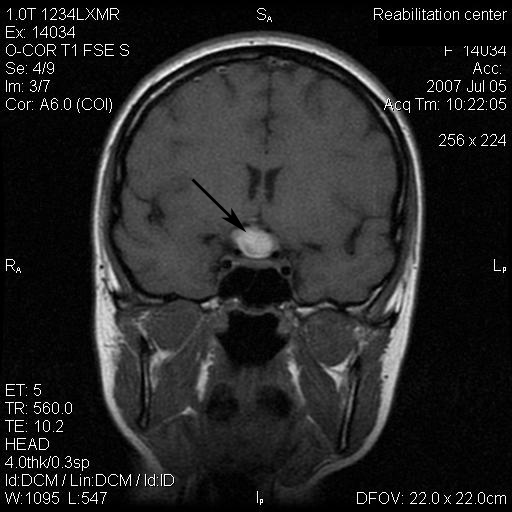
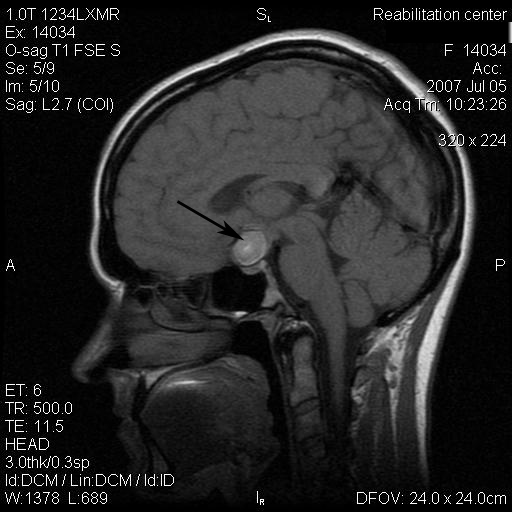
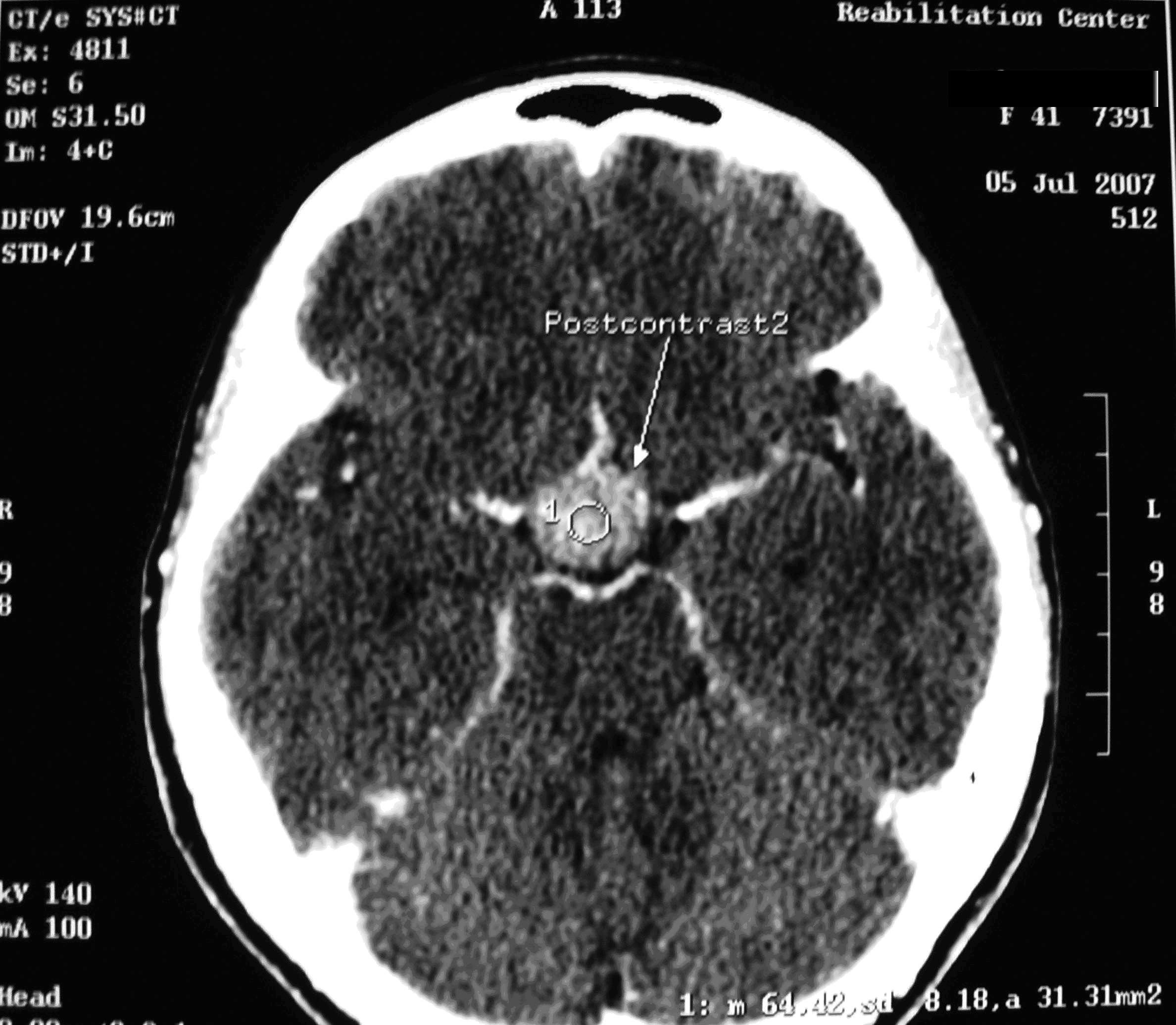
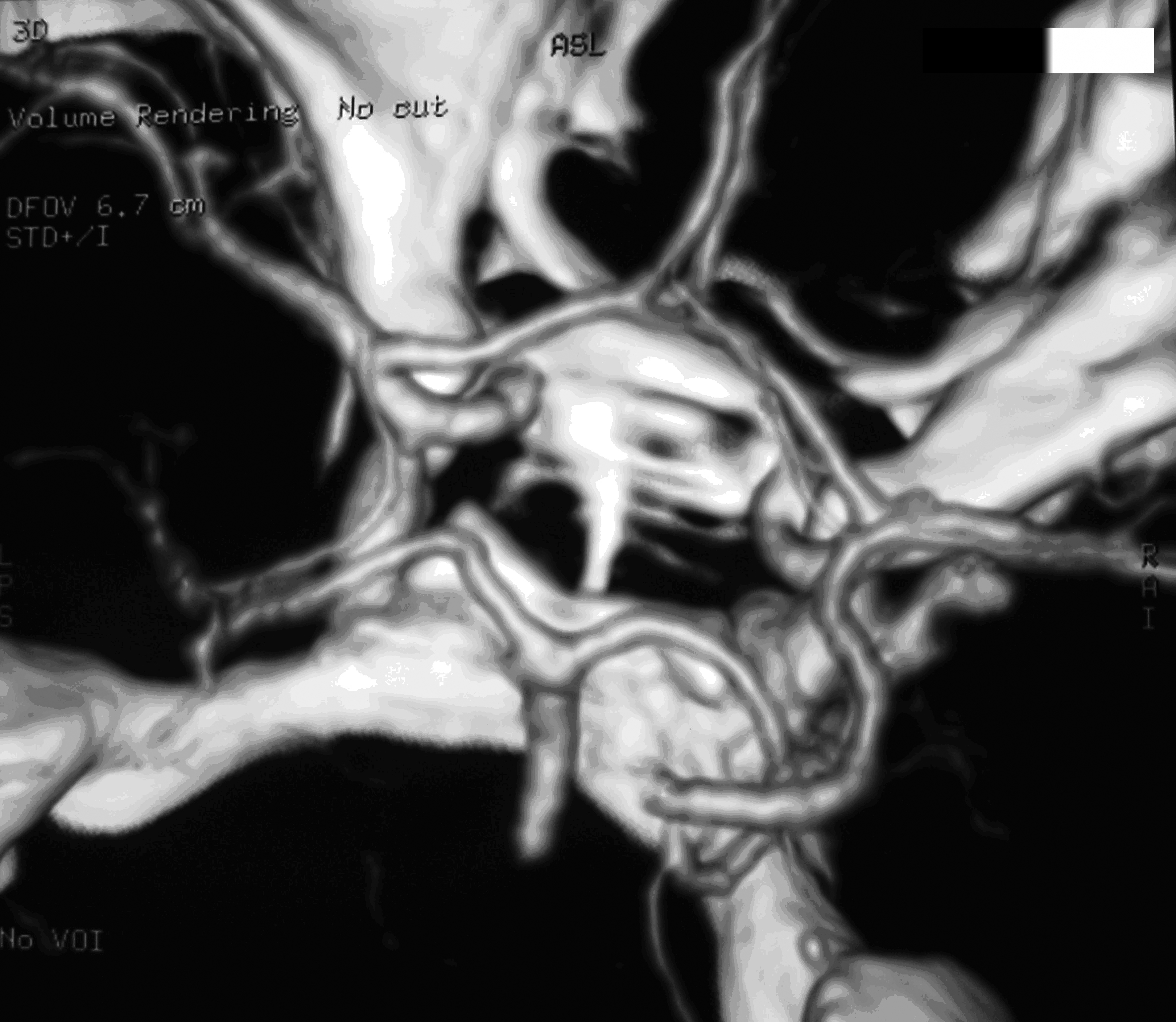
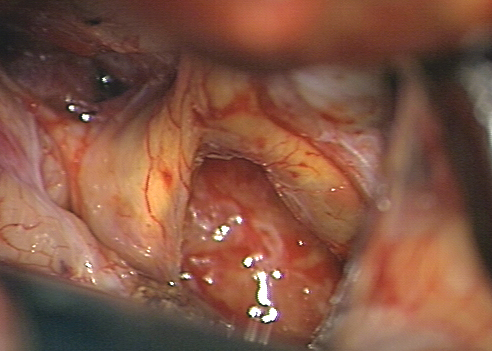
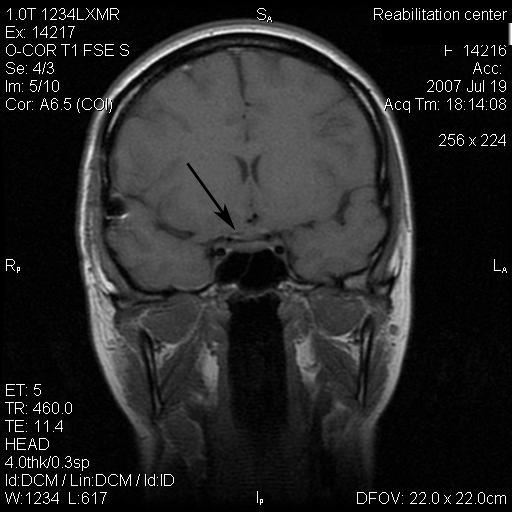
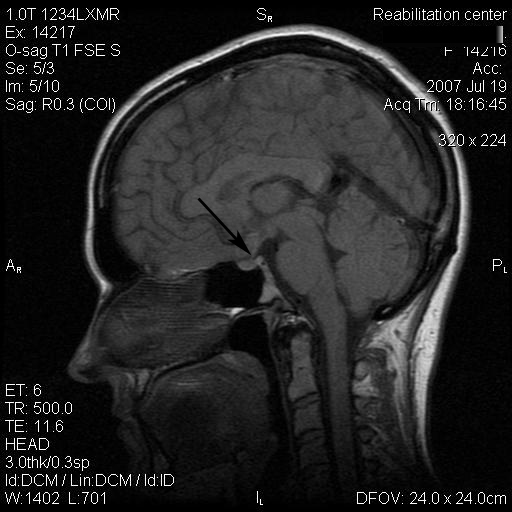
Результаты: у всех пациентов в клинической картине наблюдались парциальные приступы с вторичной генерализацией на протяжении от 6 до 22 лет до момента госпитализации. При МРТ головного мозга у троих пациентов были выявлены фокальные корковые дисплазии и у одного пациента – диффузная перивентрикулярная гетеротопия серого вещества головного мозга. Троим пациентам с ФКД была проведена имплантация кортикографических электродов для определения зоны коры ответственной за развитие приступов. Пациентам с ФКД была выполнена топэктомия очагов с интраоперационной кортикографией, пациенту с перивентрикулярной гетеротопией – лобэктомия правой лобной доли. Инфекционных и неврологических осложнений после проведенных вмешательств не отмечено. При морфологическом исследовании препаратов у 2 пациентов был выявлен Тейлоровский тип ФКД, у одной пациентки – нетейлоровский тип ФКД и у одного пациента – диффузная перивентрикулярная гетеротопия серого вещества. Через 12 месяцев в послеоперационном периоде у троих пациентов с ФКД результат хирургического лечения оценен как класс IА по шкале Engel (полное избавление от приступов), у пациента с гетеротопией серого вещества – II по шкале Engel (уменьшение частоты приступов на 50%)
Выводы. У пациентов с фармакорезистентной эпилепсией необходимо учитывать возможную этиопатогенетическую роль нарушений миграции нейронов коры. Хирургическое лечение может являться опцией, позволяющей достичь стойкой клинической ремиссии и социальной адаптации пациентов.
Опубликовано V СЪЕЗД НЕЙРОХИРУРГОВ РОССИИ, УФА 22-25 ИЮНЯ 2009г.