Нейроваскулярные взаимоотношения при гемифациальном спазме
Ю. А. Григорян, А. Р. Ситников
NEUROVASCULAR RELATIONSHIPS IN HEMIFACIAL SPASM
Yu. A. Grigoryan, A. R. Sitnikov
The article describes our results of surgical treatment of 37 patients suffered from hemifacial spasm (HS) as well as results of the morphological studies of facial nerve root exit zone (REZ). The morphological studies showed that the length of central myelin covered zone was between 0.9 and 3.6 mm long (mean - 2.24 mm). This zone didn’t spread longer than 1.1 facial nerve diameter. Intra- operatively 27 cases of compression by a single vessel and 9 cases of multiple vessels compression were found. In cases of a single vessel compression the compression was due to AICA in 11 cases, due to PICA - 12 cases and due to VA – 4 cases. In 35 cases we achieved the full decompression of facial nerve REZ. In one case the complete decompression was not possible because the penetration of the vestibular nerve by AICA, what made manipulations on this artery and on facial nerve almost impossible. Excellent results of surgical treatment achieved in 33 patients. One patient had unsatisfied outcome as mentioned above. There were no serious complications after the surgical procedure. A vascular decompression is a highly effective and relatively safe method of treatment of HS. Hemifacial spasm occurs due to compression of facial nerve’s central myelin covered zone, so the surgical decompression must be done close to REZ nearby brain stem.
Введение. Гемифациальный спазм (ГС) или болезнь Бриссо (Brissand) представляет собой нервно-мышечное заболевание, проявляющееся безболезненными односторонними насильственными клонико-тоническими сокращениями лицевой мускулатуры. Согласно P. J. Jannetta основополагающим фактором в возникновении “гиперфункциональных синдромов краниальных нервов”, включая гемифациальный спазм, является сдавление парастволовой входной/выходной зоны соответствующего нервного корешка [3, 10-12, 16]. Исследования микрохирургической анатомии корешков черепных нервов мостомозжечкового угла, показало значительную вариабельность взаиморасположения комплекса VII VIII нервов и прилежащих сосудов [10, 19, 21]. Микрохирургическая эксплорация структур мостомозжечкового угла на стороне поражения у пациентов с ГС в подавляющем большинстве случаев выявляет сосудистую компрессию корешка лицевого нерва в зоне его выхода из ствола головного мозга. Эффективность васкулярной декомпрессии в лечении ГС зависит от правильной идентификации сдавливающего сосуда, топографические взаимоотношения которого с корешком лицевого нерва имеют четкие отличительные черты, позволяющие подтвердить наличие нейроваскулярного конфликта. Неадекватная микрохирургическая эксплорация парастволового отдела лицевого нерва и неправильная идентификация сдавливающего сосуда приводят к увеличению числа осложнений и ухудшению результатов лечения ГС [1-5, 9-13, 15-20, 23]. Волокна парастволовых отделов нервных корешков окружены миелином центрального типа, образованным олигодендроглией (глиальный конус), а относительно дистальные отделы нервных волокон покрыты миелином периферического типа, сформированного Шванновскими клетками. Центральный тип миелина является менее прочным, легче подвергается разрушению при различных компрессионных воздействиях, и поэтому, сосудистое или опухолевое сдавление нервного корешка на уровне его глиального сегмента, приводит к локальной демиелинизации с последующим рядом патофизиологических феноменов, формирующих клиническую картину заболевания [1, 6, 17].
Цель настоящего исследования заключается в исследовании протяженности выходной зоны корешка лицевого нерва из ствола головного мозга, а также в оценке нейроваскулярных взаимоотношений и эффективности сосудистой декомпрессии у пациентов с ГС.
Материалы и методы. Проведено исследование 20 корешков лицевого нерва на 10 препаратах ствола головного мозга, извлеченных во время аутопсии у пациентов (6 женщин и 4 мужчин, в возрасте 60-71 лет), при жизни не страдавших заболеваниями центральной нервной системы. Для последующего исследования оставляли поперечный срез ствола головного мозга с исходящими из него волокнами лицевых нервов. Полученные после фиксации и заливки тонкие срезы окрашивались гематоксилином-эозином и по Ван-Гизону для идентификации в корешке лицевого нерва сегментов с центральным типом миелинизации. Протяженность глиального конуса измерялась от поверхности ствола головного мозга вдоль лицевого нерва до начала участка со Шванновским (периферическим) типом миелина. Анализ нейроваскулярных взаимоотношений проведен у 37 пациентов (из них женщин – 29 и мужчин - 8, в возрасте от 20 до 77 лет), страдающих ГС. Всем больным проводились неврологический осмотр, МРТ и/или КТ головного мозга. У 17 пациентов был выявлен левосторонний ГС, у 20 пациентов – правосторонний. У всех пациентов при клиническом осмотре отмечали односторонние насильственные безболезненные неконтролируемые сокращения лицевых мышц. Во всех наблюдениях отмечено типичное прогрессирующее развитие ГС, манифестирующее с подергиваний нижних отделов круговой мышцы глаза и последующим распространением в течение 1-3 лет на остальные мимические мышцы. Средняя длительность заболевания до проведения хирургического лечения составила 6, 8 года (от 1 до 16 лет). Проводимое в течение длительного времени разнообразное медикаментозное лечение и применение препаратов ботулотоксина приводило к незначительному и транзиторному уменьшению степени гемифациального спазма с неизбежным постепенным прогрессированием клинической картины. Неврологическая оценка выявила во всех случаях наличие одностороннего ГС с различным сочетанием клонических и тонических компонентов спазма. У всех больных наблюдались четкие синкинетические феномены на стороне поражения. В начальные периоды заболевание проявлялось клоническими сокращениями, а последующее распространение насильственных сокращений на большую часть мимических мышц характеризовалось нарастанием тонического компонента спазма. Слуховые феномены в виде щелчка одновременно с сокращениями мышц лица вследствие судорожного напряжения m. stapedius отмечались у 9 пациентов. Только в 6 случаях выявлены клинические признаки легкого пареза лицевого нерва (2 степень по шкале House-Brackmann), оцениваемые в межприступном интервале. Случаев семейного заболевания в представленной группе больных не зафиксировано. У 1 пациента ГС сочетался с ипсилатеральной тригеминальной невралгией (painful tic convulsif, согласно определению в англоязычной литературе) и в 1 случае наблюдалась контралатеральная тригеминальная невралгия. По МРТ головного мозга у 29 пациентов были выявлены признаки нейроваскулярного конфликта на стороне поражения и у 1 пациентки была обнаружена невринома области левого яремного отверстия. КТ и МРТ ангиография у 16 пациентов показала выраженную патологическую извитость и эктазию вертебробазилярных артерий (мегадолихобазилярная аномалия). Оперативное вмешательство осуществлялось ретромастоидальным подходом в положении больного сидя. Обнажение сосудистого сплетения в боковом вывороте IV желудочка, латеральной поверхности ствола головного мозга и зоны выхода лицевого нерва проводилось вдоль языкоглоточного нерва оттеснением вверх и медиально нижне-латеральных отделов полушария мозжечка. Идентификация сдавливающего сосуда осуществлялась последовательной микродиссекцией васкулярных структур, после чего оценивались их взаимоотношения со стволом мозга и выходной зоной корешка лицевого нерва. Декомпрессию производили путем рассечения арахноидальных сращений между стволом головного мозга, корешком лицевого нерва и сосудами. Сосудистая структура, вызывающая нейроваскулярный конфликт, отводилась от зоны выхода корешка лицевого нерва с последующей фиксацией ее нового положения с помощью нескольких участков (2-3 мм) мышечной и фасциально-жировой тканей пациента (29 случаев) или синтетических цилиндрических протекторов (8 случаев), устанавливаемых между стволом головного мозга и прилежащими сосудами.
Результаты и их обсуждение. Микроморфологические исследования выявили, что протяженность глиального конуса, т.е. участка корешка лицевого нерва с центральным типом миелинизации нервных волокон, достаточно вариабельна. Протяженность данного участка корешка от поверхности ствола головного мозга до начала периферического сегмента со Шванновским миелином составляла 0,9 — 3,6 мм (в среднем – 2,24 мм) (рис. 1).
Рис. 1 Микрофотография парастволового отдела корешка лицевого нерва (ув. 4х10, окраска гематоксилином и эозином). А – длина глиального конуса от поверхности ствола головного мозга, В – ширина нервного корешка, С – переходная зона Obersteiner-Redlich. Соотношение А/В – 1.1.
Более значительное распространение глиального конуса в относительно периферические отделы нервного корешка в сторону внутреннего слухового прохода не было выявлено ни в одном из исследованных нами препаратов. Сопоставление протяженности парастволовых сегментов центрального типа миелинизации с обеих сторон ствола головного мозга выявило незначительную асимметрию глиального конуса в пределах 0,1- 0,8 мм (в среднем — 0,3 мм). Сходные результаты были опубликованы ранее различными авторами. Так, H. Skinner, оценивая результаты собственных исследований миелинизации нервных корешков на препаратах ствола головного мозга, показал, что расстояние между стволом мозга и отрезком нерва, волокна которого покрыты миелином Шванновских клеток (длина глиального конуса) является специфичным для разных черепных нервов. Согласно исследованиям аутопсийного материала автор обнаружил, что длина глиального конуса корешка лицевого нерва равна в среднем 2,5 мм [24]. В работе, посвященной анатомическому исследованию краниальных нервов, J. Lang и U. Reiter было показано, что от поверхности ствола головного мозга сегмент лицевого нерва с центральным типом миелинизации распространяется на 2,05 мм [14]. В нашем исследовании поперечный размер корешка лицевого нерва в парастволовой зоне составлял в среднем 2,21 мм, варьируя от 1,9 до 3,7 мм. Полученные результаты позволяют приблизительно оценить протяженность глиального конуса относительно толщины нервного корешка во время хирургического вмешательства. Согласно представленным данным длина выходной зоны с центральным типом миелинизации в 1,1 раз превышала толщину корешка лицевого нерва. Полученные нами данные подтверждают предположение о том, что интраоперационные манипуляции, направленные на выявление и устранение сосудистой компрессии корешка лицевого нерва должны проводиться на небольшом (до 4 мм) участке парастволовой зоны, протяженность которого приблизительнео равна толщине нервного корешка. M. Tomii и соавт. показали, что после выхода из понтомедуллярной борозды лицевой нерв плотно сращен с боковой поверхностью ствола головного мозга на протяжении 8-10 мм и потом отделяется от поверхности Варолиева моста, формируя цистернальный сегмент [25]. Эти данные указывают на необходимость хирургической эксплорации участка ствола головного мозга, расположенного вентрокаудальнее от цистернального сегмента лицевого нерва, во время оценки нейроваскулярных взаимоотношений при ГС. Дополнительные хирургические действия на относительно периферических (дистальных) отделах корешка лицевого нерва не являются оправданными с позиции теории нейроваскулярной компрессии и могут привести к нежелательным неврологическим последствиям. У всех пациентов с ГС была обнаружена компрессия выходной зоны корешка лицевого нерва из ствола головного мозга. В 27 случаях была выявлена компрессия одним сосудом и в 9 – несколькими васкулярными структурами. В группе одиночных компрессионных воздействий сдавление корешка лицевого нерва было вызвано передней нижней мозжечковой артерией (ПНМА) у 11 пациентов, задней нижней мозжечковой артерией (ЗНМА) - у 12 пациентов и у 4 больных выявлена компрессия позвоночной артерией (ПА), причем у 2 из них в нейроваскулярном конфликте участвовала противоположная ПА [7, 8]. В случаях множественной компрессии, вызывающей нейроваскулярный конфликт, обнаружены следующие варианты сочетанного расположения сосудов в выходной зоне корешка лицевого нерва: ПА + ЗНМА – 4 пациента, ПА + ПНМА — 1, ПНМА + длинная огибающая артерия ствола — 1, ЗНМА + ПНМА — 1, БА + ПНМА – 1 и ПНМА + вена – 1 пациент. В 1 наблюдении невриномы яремного отверстия после диссекции и удаления опухоли было обнаружено сдавление выходной зоны корешка лицевого нерва петлей ЗНМА, смещенной опухолевым узлом вверх. В 35 случаях последовательная микродиссекция арахноидальных сращений позволила мобилизовать васкулярные структуры и отвести их от ствола головного мозга для полноценной декомпрессии выходной зоны корешка лицевого нерва. В 1 наблюдении адекватная декомпрессия не была достигнута ввиду того, что в аномальной петле ПНМА, поднимавшейся вверх от ствола мозга располагались волокна вестибулокохлеарного нерва. Отведение артерии от ствола головного мозга и корешка лицевого нерва вследствие имеющихся анатомических особенностей неизбежно привело бы к повреждению волокон вестибулокохлеарного нерва. У пациентки с невриномой яремного отверстия проведено тотальное удаление опухоли с васкулярной декомпрессией корешка лицевого нерва. При одностороннем сочетании ГС и тригеминальной невралгии проведена одновременная декомпрессия корешков лицевого и тройничного нервов [7], а в случае сочетания с контралатеральной невралгией тройничного нерва лицевая пароксизмальная боль устранена чрезкожной радиочастотной тригеминальной ризотомией. Летальных исходов и инфекционных осложнений после хирургического лечения в представленной группе больных не было зафиксировано. Среди неврологических осложнений нейроваскулярной декомпрессии отмечены признаки локального тракционного поражения комплекса вестибулокохлеарный – лицевой нервы. У 9 пациентов наблюдалось послеоперационное снижение слуха на стороне проведенного вмешательства, которое у 3 из них сочеталось с ощущением заложенности уха. У этих 3 больных нарушение слуха было обусловлено вскрытием и последующей тампонадой воздухоносных ячеек сосцевидного отростка и спустя 1-2 месяца отмечено восстановление функции слуха. У остальных 6 пациентов восстановления слуховой функции не наблюдалось. В 2 наблюдениях на фоне резкого снижения слуха выявлен транзиторный ипсилатеральный парез лицевого нерва до 3 баллов по шкале House-Brackmann, регресс которого отмечался в течение 1 и 3 месяцев соответственно. У 34 пациентов ближайший результат хирургического лечения оценен как отличный, характеризующийся полным исчезновением клонико-тонических сокращений и синкинезий лицевой мускулатуры. В 1 случае, когда по указанным выше причинам не была произведена адекватная сосудистая декомпрессия, клиническая картина ГС не претерпела изменений. Следует особо подчеркнуть, что у 2 пациентов с послеоперационным тракционным парезом лицевого нерва восстановление функций мимических мышц не привело к возобновлению ГС. Таким образом, полное исчезновение клинических проявлений ГС было достигнуто у 36 из 37 оперированных пациентов. У большинства пациентов клинические проявления исчезли сразу же после операции, а в 8 наблюдениях ГС, затухающий по своей частоте и выраженности, наблюдался в течение 3-7 дней после сосудистой декомпрессии до полного регресса неврологических проявлений. Вместе с исчезновением ГС отмечен регресс легкого пареза лицевого нерва, имеющегося в дооперационном периоде. При этом замечено, что у пациентов с более длительным анамнезом заболевания и выраженным тоническим компонентом спазма регресс симптомов наступал несколько позже, чем у пациентов, которым хирургическое лечение было проведено в сравнительно ранние сроки с преимущественно клоническим типом ГС. Отдаленные результаты сосудистой декомпрессии прослежены у 32 пациентов. Срок последующего наблюдения за оперированными пациентами составил в среднем 9,7 лет (от 1 до 18 лет). Каких-либо отсроченных неврологических осложнений, также как и рецидивов ГС отмечено не было. Полученные нами результаты подтверждают общепризнанное мнение о ведущей роли сосудистой компрессии глиального сегмента корешка лицевого нерва в возникновении ГС. Во всех случаях во время микрохирургической эксплорации выявлено сдавление различными сосудами парастволового отдела лицевого нерва с его четким перегибом и деформацией, а иногда и образованием борозды вдавления. Обнаруживаемая деформация нервных волокон выявлялась вблизи ствола мозга, причем часто сдавливающая сосудистая структура прилежала непосредственно к стволу головного мозга. По протяженности дислоцированная и деформированная часть корешка лицевого нерва составляла обычно не более 3 мм от поверхности ствола головного мозга, незначительно распространяясь на свободный цистернальный сегмент нерва. Нейроваскулярные конфликты при ГС в зависимости от сдавливающих сосудов можно условно подразделить на три типа. Первый тип представлен дополнительными петлями мозжечковых артерий (ПНМА и ЗНМА), внедряющихся в зону выхода корешка лицевого нерва (рис. 2).
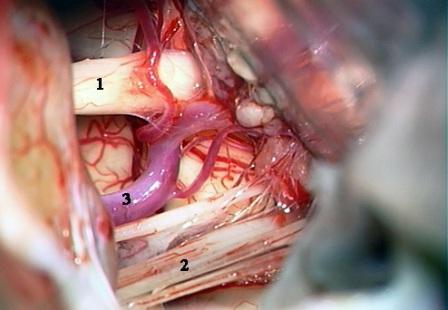
Рис. 2. Интраоперационная фотография при ГС слева. Компрессия лицевого нерва петлей передней нижней мозжечковой артерией.
Второй топографический вариант нейроваскулярного конфликта обусловлен патологической деформацией таких крупных сосудов как ПА и БА (рис. 3) и третий включает в себя особенности первых двух вариантов (рис. 4).
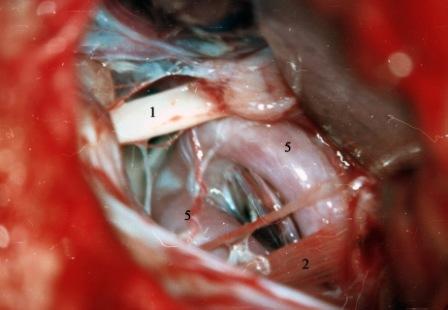
Рис. 3. Интраоперационная фотография при ГС слева. Компрессия лицевого нерва контралатеральной позвоночной артерией.
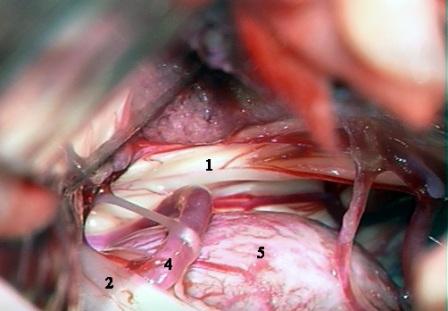
Рис. 4. Интраоперационная фотография при ГС справа. Компрессия лицевого нерва позвоночной и задней нижней мозжечковой артериями.
Основной принцип устранения нейроваскулярного конфликта при лечении ГС заключается в проведении микрохирургических манипуляций на сосудистых и арахноидальных структурах с минимальным инструментальным воздействием на ствол головного мозга и корешок лицевого нерва. Необходимо подчеркнуть, что в нейроваскулярном конфликте, вызванном ПНМА или ЗНМА, обычно участвуют начальные сегменты этих петлеобразно изогнутых артерий. Проведение микрохирургической декомпрессии корешка лицевого нерва в случаях сдавления нервных волокон петлями ЗНМА и ПНМА требует мобилизации артериального сосуда на протяжении от ствола головного мозга или позвоночной артерии до перехода на полушарие мозжечка в случае ПНМА или места прохождения ЗНМА под каудальной группой черепных нервов. Подобная методика протяженной мобилизации мозжечковых сосудов позволяет значительно сместить в сторону от ствола головного мозга и корешка лицевого нерва сдавливающий сосуд, выделить и сохранить тонкие перфорирующие ветви и предупредить перегибание, особенно под острым углом, артериального ствола с целью профилактики ишемических поражений ствола головного мозга и мозжечка. После завершения мобилизации и транспозиции сдавливающего сосуда, обычно в каудолатеральном направлении, фиксация вновь созданных топографических взаимоотношений легко достигается сочетанной установкой нескольких фрагментов мягких аутоимплантатов (мышца, жир, фасция) между стволом головного мозга и артерией (рис. 5, а, б, в).
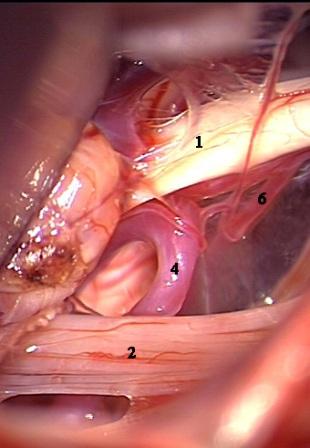
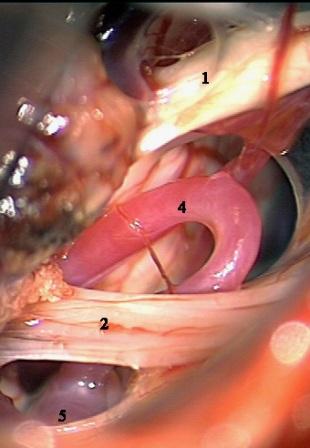
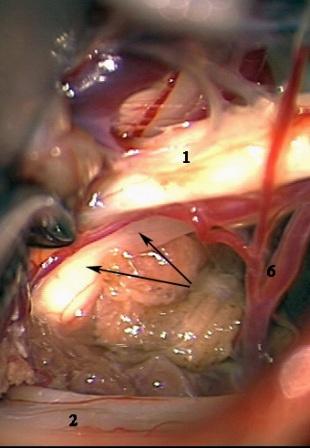
Рис. 5. Интраоперационная фотография при ГС справа. Компрессия лицевого нерва петлей задней нижней мозжечковой артерии. а – первоначальная картина нейроваскулярного конфликта. б – артериальная петля смещена вниз от лицевого нерва в – между стволом головного мозга и артерией установлен фрагмент мышечной ткани. Сращенный со стволом головного мозга участок лицевого нерва (стрелки) деформирован в месте имевшегося сосудистого сдавления.
Условные обозначения для рисунков 2-5:
1 – вестибулокохлеарный-лицевой нервы
2 – каудальная (IX-XI) группа нервов
3 – передняя нижняя мозжечковая артерия
4 – задняя нижняя мозжечковая артерия
5 – позвоночная артерия
6 – ветви передней нижней мозжечковой артерии
Идентификация второго типа нейроваскулярного конфликта требует некоторой модификации общепринятой методики сосудистой декомпрессии. Важной отличительной чертой компрессии такими крупными сосудами как ПА и БА является сдавление не только выходной зоны корешка лицевого нерва, но деформация и дислокация ствола головного мозга, особенно в случаях мегадолихобазилярной аномалии. Мобилизация этих значительных по размеру артерий весьма затруднена по ряду причин. Атеросклеротические изменения стенок артерий, приводящие к повышенной твердости и хрупкости, не позволяют смещать их на необходимое расстояние в латеральном направлении для декомпрессии ствола головного мозга с выходящим из него корешком лицевого нерва. Другой важной чертой подобных вариантов конфликта является наличие в зоне хирургических манипуляций перфорантных сосудов ствола головного мозга, отходящих непосредственно от стенки смещаемого сосуда, а также более крупных ветвей таких, как ПНМА, ЗНМА и огибающие артерии. Осторожная арахноидальная микродиссекция и поэтапное постепенное латеральное смещение крупного сосуда должны проводиться на сравнительно большом протяжении вдоль ствола головного мозга. Этот прием приводит к смещению артерии всего на 2-3 мм на уровне верхней и нижней границ диссекции, но позволяет осуществить значительную латеральную транспозицию, как правило, достаточную для полноценной декомпрессии зоны выхода корешка лицевого нерва. В большинстве случаев длина субарахноидальных отрезков перфорирующих артерий оказывается достаточной для безопасного отведения артерии от ствола головного мозга. Новое расположение крупной артериальной структуры закрепляется установкой между сосудами и стволом головного мозга нескольких фрагментов мягких имплантатов, размеры которых минимальны на верхней и нижней границах диссекции, и максимальны на уровне зоны выхода корешка лицевого нерва. Устранение третьего типа нейроваскулярного конфликта при ГС требует комбинированного применения представленных выше микрохирургических приемов. Наш опыт показал, что более целесообразно начинать декомпрессию с мобилизации ПА и БА, так как первоначальная диссекция крупных сосудов облегчает последующее выделение и транспозицию сравнительно мелких ПНМА и ЗНМА. В некоторых случаях после завершения декомпрессии парастволового отрезка на свободных (цистернальных) отделах лицевого нерва и прилежащего к нему вестибулокохлеарного нерва определяются сосудистые структуры, обычно представленные сравнительно тонкими ветвями ПНМА (рис. 5, а, б, в). Эти сосуды, располагающиеся вблизи внутреннего слухового прохода, лежат вдоль волокон нервов, не оказывая перекрестного компрессионного воздействия, и не имеют существенного значения в патогенезе ГС. Данное утверждение основывается на полном регрессе клинической картины заболевания после проведении сосудистой декомпрессии выходной зоны корешка лицевого нерва при сохранности васкулярных контактов на дистальном отрезке лицевого нерва. Необходимость хирургических манипуляций на дистальных участках лицевого нерва возникает только в случаях отсутствия компрессии парастволового отрезка (выходной зоны) и обнаружении перекрестного расположения сосуда относительно волокон лицевого нерва вблизи внутреннего слухового прохода [22]. Применение синтетических цилиндрических протекторов, окружающих артериальную структуру и «изолирующих» сосуд от прилежащих нервных структур, возможно, согласно нашему опыту, лишь в некоторых случаях первого варианта нейроваскулярного конфликта при ГС. В представленной группе пациентов среди 6 наблюдений с послеоперационным перманентным снижением слуха (в 2 из которых отмечался транзиторный парез лицевого нерва), синтетические цилиндрические протекторы использованы в 5 случаях. Фиксация нового положения артерии свободно установленными вокруг сосуда цилиндрическими протекторами представляется ненадежной из-за сравнительно легкой смещаемости кольцевидного имплантата, вследствие чего иногда требуется использование нескольких протекторов различного диаметра. Большая протяженность диссекции сосуда, опасность перегиба перфорирующих артерий на поперечных срезах цилиндрического протектора, а также необходимость установки нескольких колец для надежной декомпрессии и более высокий риск повреждений сосудистых и нервных структур послужили основанием для практически полного отказа в нашей практике от использования этого вида имплантатов. Применение кольцевидных цилиндрических имплантатов может быть полезным для прочной фиксации отведенных от ствола головного мозга ПА и БА с помощью дополнительных швов к твердой мозговой оболочке. В большинстве случаев ГС нами использованы мягкие протекторы — аутоимплантаты (мышца, жир, фасция) для окончательной фиксации вновь созданных нейроваскулярных взаимоотношений. Подобный выбор обусловлен не только постоянной доступностью материала, но и легкостью его моделирования по размерам и форме для каждого этапа конкретной ситуации. Основной целью установки имплантатов является не устранение компрессионного воздействия, а фиксация новых топографических взаимоотношений между нервными и васкулярными структурами, что надежно обеспечивается применяемыми аутотканями в процессе последующего рубцевания.
Выводы.
1. ГС развивается вследствие васкулярной компрессии парастволового отдела корешка лицевого нерва избыточными петлями ПНМА и ЗНМА (первый тип), ПА и БА (второй тип) и комбинированным воздействием этих артерий (третий тип).
2. Поиск васкулярной компрессии у пациентов с ГС должен проводиться на уровне глиального сегмента корешка лицевого нерва, распространяющегося в среднем на 2,2 мм (максимально до 3,6 мм) от поверхности ствола головного мозга.
3. Методика сосудистой декомпрессии должна быть модифицирована соответственно обнаруженному во время оперативного вмешательства варианту нейроваскулярного конфликта.
4. Васкулярная декомпрессия корешка лицевого нерва при ГС является высокоэффективным методом лечения, характеризующимся полным и перманентным устранением гиперкинезов при сравнительно низкой частоте осложнений.
ЛИТЕРАТУРА
-
Оглезнев К. Я., Григорян Ю. А., Шестериков С. А. Патофизиологические механизмы возникновения и методы лечения лицевых болей – Наука, Новосибирск, 1990.
-
Оглезнев К. Я., Григорян Ю. А., Шестериков С. А. Декомпрессия лицевого нерва при фациальном гемиспазме // Вопр. нейрохир. – 1993. – N.1. – С. 12 – 15.
-
Barker F. G., Jannetta P. J., Bissonette D. J., Shields P. T., Larkins M. V., Jho H. D. Microvascular decompression for hemifacial spasm // J. Neurosurg. – 1995. – V. 82, N 2. – P. 201 – 210.
-
Campos-Benitez M., Kaufmann A. M. Neurovascular compression findings in hemifacial spasm. // J. Neurosurg. – 2008. – V. 109, N 3. – P. 416 – 420.
-
Dannenbaum M., Lega B. C., Suki D., Harper R. L., Yoshor D. Microvascular decompression for hemifacial spasm: long-term results from 114 operations performed without neurophysiological monitoring. // J. Neurosurg. – 2008. – V. 109, N 3. – P. 410 – 415.
-
De Ridder D., Moller A., Verlooy J., Cornelissen M., De Ridder L. Is the root entry/exit zone important in microvascular compression syndromes? // Neurosurgery. – 2002. – V. 51, N 2. – P. 427 – 433.
-
Grigoryan Y. A., Dreval O. N., Michailova S. I. Painful tic convulsif caused by a contralateral vertebral artery // Surg. Neurol. – 1991. – V. 35, N 6. – P. 471 – 474.
-
Grigoryan Y. A., Goncharov M. Z., Lazebny V. V. Hemifacial spasm caused by a contralateral vertebral artery: case report // Surg. Neurol. – 2000. – V. 53, N 5. – P. 493 – 497.
-
Huang C. - I., Chen I. - H., Lee L. - S. Microvascular decompression for hemifacial spasm. Analyses of operative findings and results in 310 patients // Neurosurgery. – 1992. – V. 30, N 1. – P. 53 – 57.
-
Jannetta P. J. Hemifacial spasm // The cranial nerves: anatomy, pathology, pathophysiology, diagnosis, treatment / Eds. Samii M., Jannetta P. J. – Berlin, Springer, 1981. – P. 484 – 493.
-
Jannetta P. J. Neurovascular compression of the facial nerve in hemifacial spasm: relief by microsurgical technique // Reconstructive Surgery of Brain Arteries / Ed. Merei F. T. – Budapest, 1974. – P. 193 – 199.
-
Jannetta P. J. Neurovascular compression in cranial nerve and systemic disease // Ann. Surg. – 1980. – V. 192. – P. 518 – 524.
-
Kalkanis S. N., Eskandar E. N., Carter B. S., Barker F. G., // Microvascular decompression surgery in the United States, 1996 to 2000: mortality rates, morbidity rates, and the effects of hospital and surgeon volumes // Neurosurgery. – 2003. – V. 52, N 6. – P. 1251 – 1262.
-
Lang J., Reiter U. Über die intrazisternale Länge der Hirnnerven VII-XII. // Neurochirurgia. – 1985. – V. 28, N 4. – P. 153 – 157.
-
Loeser J. D., Chen J. Hemifacial spasm: treatment by microsurgical facial nerve decompression // Neurosurgery. – 1983. – V. 13, N 1. – P. 141 – 146.
-
McLaughlin M. R., Jannetta P. J., Clyde B. L., Subach B. R., Comey C. H., Resnick D. K. Microvascular decompression of cranial nerves: lessons learned after 4400 operations // J. Neurosurg. – 1999. – V. 90, N 1. – P. 1 – 8.
-
Moller A. R. The cranial nerve vascular compression syndrome: I. A review of treatment // Acta. Neurochir. (Wien). – 1991. - V. 113, N 1-2. – P. 18 -23.
-
Nagahiro S., Takada A., Matsukado Y., Ushio Y. Microvascular decompression for hemifacial spasm. Patterns of vascular compression in unsuccessfully operated patients // J. Neurosurg. – 1991. – V. 75, N 3. – P. 388 – 392.
-
Naraghi R., Tanrikulu L., Troescher-Weber R., Bischoff B., Hecht M., Buchfelder M., Hastreiter P. Classification of neurovascular compression in typical hemifacial spasm: three-dimensional visualization of the facial and vestibulocochlear nerves // J. Neurosurg. – 2007. – V. 107, N 6. – P. 1154 – 1163/
-
Payner T. D., Tew J. M., Jr. Recurrence of hemifacial spasm after microvascular decompression // Neurosurgery. – 1996. – V. 38, N 4. – P. 686 – 691.
-
Rhoton A. L., Jr. The cerebellopontine angle and posterior fossa cranial nerves by the retrosigmoid approach // Neurosurgery. – 2000. – V. 47. – Suppl. 3. – P. 93 – 129.
-
Ryu H., Yamamoto S., Sugiyama K., Uemura K., Miyamoto T. Hemifacial spasm caused by vascular compression of the distal portion of the facial nerve. Report of seven cases. // Neurosurgery. – 1998. – V. 88, N 3. – P. 605-609.
-
Samii M., Günther T., Iaconetta G., Muehling M., Vorkapic P., Samii A., Microvascular decompression to treat hemifacial spasm: long-term results for a consecutive series of 143 patients // Neurosurgery. – 2002. – V. 50, N 4. – P. 712 – 719.
-
Skinner H. A. Some histologic features of the cranial nerves // Arch. Neurol. Psychiatry. – 1931. – V. 25. – P. 356 – 372.
-
Tomii M., Onoue H., Yasue M., Tokudome S., Abe T. Microscopic measurement of the facial nerve root exit zone from central glial myelin to peripheral Schwan cell myelin // J. Neurosurg. – 2003. – V. 99, N 1. – P. 121 – 124.
Опубликовано Журнал «Вопросы нейрохирургии им. акад. Н. Н. Бурденко».- 2009. - № 4. – С. 13 – 16