Тригеминальная невралгия и опухоли мостомозжечкового угла
Григорян Ю. А., Ситников А. Р.
Grigoryan Yu. A., Sitnikov A. R.
TRIGEMINAL NEURALGIA AND CEREBELLOPONTINE ANGLE TUMORS
Резюме
Оптимальная тактика лечения тригеминальной невралгии (ТН), сочетающейся с опухолями мостомозжечкового угла (ММУ) остается неопределенной. Целью работы являлось определение взаимоотношений корешка тройничного нерва с объемными образованиями и сосудистыми структурами. Проведен ретроспективный анализ 211 пациентов с ТН, подвергшихся хирургической эксплорации ММУ. У 21 (10%) больных выявлены ипсилатеральные опухоли ММУ (12 менингиом, 6 эпидермоидов и 3 вестибулярные невриномы). Обнаружено пять различных типов компрессии входной зоны корешка тройничного нерва опухолями и окружающими сосудами. Непосредственная компрессия нервного корешка только опухолью (типы I и II) отмечено в 14 случаях, двойное сдавление опухолью и верхней мозжечковой артерией (типы III и IV) – в 6 (4 менингиомы и 2 невриномы), а венозная компрессия без деформации нервных волокон опухолью (тип V) – в 1 случае менингиомы. Во всех наблюдениях опухоли были удалены и в 7 дополнительно проведена микроваскулярная декомпрессия. Исчезновение ТН наблюдалось у всех пациентов без стойких неврологических последствий и летальных исходов. ТН наиболее часто возникает вследствие прямой компрессии и перегиба корешка тройничного нерва опухолью ММУ. В некоторых случаях причиной боли является двойная компрессия опухолью и артериальным сосудом. После удаления опухолей ММУ необходимо проведение тщательного осмотра входной зоны корешка тройничного нерва для оценки нейроваскулярных взаимоотношений. При обнаружении сопутствующей сосудистой компрессии корешка тройничного нерва с целью устранения ТН должная быть проведена нейроваскулярная декомпрессия.
Abstract
The optimal management of trigeminal neuralgia (TN) associated with cerebellopontine angle (CPA) tumors is unclear. The aim of this study was to determine relationships between the trigeminal nerve root, CPA mass lesions and vascular structures. Retrospective review of 211 patients with TN treated with CPA exploration was conducted. Twenty one (10%) patients have had ipsilateral CPA tumors (12 meningiomas, 6 epidermoids, and 3 vestibular neurinomas). Five different types of a trigeminal nerve root entry zone compression by tumors and surrounding vessels were observed. Direct compression of the nerve root by a tumor (types I and II) was noted in 14 patients, dual compression by tumor and superior cerebellar artery (types III and IV) was found in 6 patients (4 meningiomas and 2 neurinomas), and venous compression without distortion of the nerve fibers by tumor (type V) was found in 1 patient with meningioma. All tumors were removed with additional performance of microvascular decompression in 7 patients. Complete relief of TN was achieved in all cases without permanent neurological complications and postoperative mortality. TN can result mostly from direct compression and distortion of the trigeminal nerve root by CPA tumors. In some cases double compression of the nerve by the tumor and the artery can be responsible for facial pain. Careful inspection of the trigeminal nerve root entry zone is strongly recommended after resection of the CPA tumor for estimation of neurovascular relationships. When coexistent vascular compression of the trigeminal nerve root appears, neurovascular decompression is necessary for permanent cure of symptoms.
Ключевые слова: мостомозжечковый угол, эпидермоид, менингиома, нейроваскулярная декомпрессия, невринома, тригеминальная невралгия
Key words: cerebellopontine angle, epidermoid, meningioma, microvascular decompression, neurinoma, trigeminal neuralgia
Неврологический диагноз тригеминальной невралгии основывается на специфических клинических характеристиках лицевой боли, таких как продолжительность приступов, локализация и распространение болезненных ощущений, наличие рефрактерного периода и триггерных зон, снижение интенсивности и уменьшение частоты пароксизмов при приеме противосудорожных препаратов, но не включает этиологические аспекты возникновения болевого синдрома. Морфологической основой развития невралгического синдрома является демиелинизация входной зоны корешка тройничного нерва в ствол головного мозга, сопровождающаяся определенными периферическими и центральными патофизиологическими механизмами, клинически манифестирующимися приступообразной лицевой болью. Опыт хирургического лечения тригеминальной невралгии, а также результаты нейровизуализационных исследований показали, что в подавляющем большинстве случаев причиной пароксизмов лицевой боли является васкулярная компрессия корешка тройничного нерва, наиболее часто обусловленная избыточными петлями верхней мозжечковой артерии, а также другими артериальными и венозными сосудами [1 – 7, 12, 17]. В ряде случаев при невралгии тройничного нерва обнаруживаются различные по структуре и локализации опухоли головного мозга, которые рассматриваются в качестве ведущего этиологического фактора возникновения лицевой боли. Разнообразные по своему морфологическому строению опухоли, вызывающие пароксизмальную лицевую боль, располагаются в различных областях головного мозга и основания черепа и воздействуют на периферические ветви, ганглий, корешок и стволовые структуры тройничного нерва. E. Bullitt и соавт. [9] обнаружили 16 опухолей головного мозга среди 2000 пациентов с лицевой болью, причем невралгия тройничного нерва обычно сопровождала опухоли задней черепной ямки, а атипические варианты лицевой боли наблюдались при локализации новообразований в средней черепной ямке и по ходу периферических тригеминальных ветвей. Тригеминальная невралгия при опухолях мостомозжечкового угла возникает в результате прямого или опосредованного механического воздействия прилежащей опухоли на корешок тройничного нерва [3, 8, 10, 11, 13, 14, 16, 19 – 22, 24 – 28, 31, 33 – 35]. A. G. Revilla провел анализ хирургических находок среди 473 пациентов с тригеминальной невралгией, оперированных W. E. Dandy, и выявил опухоли мостомозжечкового угла в 24 (5.1%) наблюдениях, причем в 11 (46%) случаях обнаружены невриномы, в 9 (38%) – эпидермоиды и в 4 (16%) – менингиомы [29]. На материале T. Fukusima количество опухолей мостомозжечкового угла составило 9.5% в группе из 1257 пациентов с невралгией тройничного нерва, а по данным F. G. Barker и соавт. частота подобных опухолей в серии P. J. Jannetta из 1211 больных достигла всего 2.1% [8, 13]. Непосредственное сдавление и деформация корешка тройничного нерва часто наблюдаются при доброкачественных, медленно растущих опухолях мостомозжечкового угла, однако, по мнению P. J. Jannetta, тригеминальная невралгия и в этих случаях имеет васкулярную природу, так как пароксизмальная боль развивается только при сдавлении нервных волокон прилежащим сосудом [8, 17]. В настоящей работе рассматриваются хирургические находки у пациентов с тригеминальной невралгией и новообразованиями мостомозжечкового угла с анализом взаимоотношений корешка тройничного нерва с прилежащими опухолями и сосудистыми структурами.
Материал и методы. Клинический материал основан на 21 пациентах с опухолями мостомозжечкового угла, выявленных в группе из 211 больных с тригеминальной невралгией, подвергшихся микрохирургической эксплорации входной зоны корешка тройничного нерва в ствол головного мозга. Возраст пациентов колебался от 31 до 74 лет (в среднем 54,3 лет), из них 15 женщин и 6 мужчин. Во всех случаях проведено общее клинико-лабораторное обследование, оценка неврологического статуса и МРТ головного мозга. Все больные подверглись оперативному лечению под эндотрахеальным наркозом. Хирургические вмешательства были направлены на удаление опухолей, и взаимоотношения патологических новообразованиий с прилежащими к ним нервными и сосудистыми структурами документировались для последующего дополнительного анализа. Контрольные КТ головного мозга проводились на следующий день после оперативного вмешательства, и окончательная оценка радикальности удаления опухоли производилась спустя 7 – 9 дней по результатам МРТ с контрастированием.
Результаты. Согласно результатам микроморфологического исследования обнаруженные опухоли мостомозжечкового угла были представлены менингиомами в 12 случаях, эпидермоидами – в 6 и невриномами – в 3 наблюдениях. Все пациенты страдали односторонней лицевой болью, клинические характеристики которой полностью соответствовали критериям синдрома тригеминальной невралгии. Во всех наблюдениях опухоль мостомозжечкового угла и невралгия тройничного нерва локализовались на одной и той же стороне, в 12 случаях – справа и в 9 – слева. Возраст пациентов на момент манифестации пароксизмальной лицевой боли составил в среднем 49,6 лет (от 23 до 70 лет), причем первые проявления тригеминальной невралгии наиболее рано возникли у больных с эпидермоидами (34 года), а в случаях с менингиомами (58,4 лет) и невриномами (54 года), клинические проявления развивались значительно позже. Длительность заболевания до проведения хирургического вмешательства колебалась от 2 месяцев до 16 лет (в среднем 4,8 лет) и наибольшее значение этого показателя отмечалось в группе пациентов с эпидермоидами мостомозжечкового угла (6,8 лет). Пароксизмальный болевой синдром и триггерные зоны в 9 случаях захватывали одновременно максиллярную и мандибулярную ветви тройничного нерва, а в 3 – всю половину лица. Изолированное поражение мандибулярной ветви отмечено у 3 и максиллярной – у 6 больных. Таким образом, во всей анализируемой группе пациентов отмечено поражение 36 ветвей тройничного нерва, причем наиболее часто вовлекались максиллярная (18 раз) и мандибулярная (15 раз) ветви, и значительно реже –офтальмическая (3 раза). Для лечения тригеминальной невралгии на догоспитальном этапе без проведения исследований, указывающих на наличие опухоли мостомозжечкового угла, проводилась малоэффективная терапия препаратами карбамазепина в постепенно нарастающих дозировках. Химические деструкции (алкоголизации) проведены у 3 и гидротермическая деструкция корешка – у 1 пациентов, однако эти процедуры не принесли заметного облегчения или характеризовались непродолжительным, до 2 – 4 месяцев, умеренно выраженным положительным эффектом. У 1 больной с менингиомой верхушки пирамиды височной кости стереотаксическая радиохирургия на установке “Gamma knife” не привела в течение последующего года к ослаблению болевого синдрома и изменению размеров опухоли. У 4 пациентов, подвергшихся указанным выше манипуляциям на периферических ветвях тройничного нерва, при поступлении выявлялась различной степени выраженности гипестезия в соответствующих зонах лица. Среди остальных 17 пациентов легкое снижение чувствительности на коже лица и слизистых оболочках было отмечено в 10 случаях. Тригеминальная невралгия у всех 6 больных с эпидермоидами и у 5 из 12 пациентов с менингиомами мостомозжечкового угла, представляла собой единственное клиническое проявление заболевания. У остальных пациентов с менингиомами (7/12) и невриномами (3/3) лицевая боль сопровождалась дополнительными неврологическими нарушениями, проявляющимися снижением или выпадением слуха, атаксией и нистагмом. Нейрорадиологическое обследование показало наличие объемных образований мостомозжечкового угла с различными характеристиками. Все наблюдавшиеся опухоли, кроме эпидермоидов, согласно данным КТ и МРТ имели округлую форму и хорошо контрастировались. В представленной нами серии размеры менингиом и неврином колебались от 1.5 см до 4.5 см. Размеры эпидермоидов варьировали от 3 до 6 см, причем в 3 случаях отмечалось значительное супратенториальное распространение в параселлярные цистерны, а в 2 – опухолевые массы достигали контралатерального мостомозжечкового угла. Все опухоли удалялись ретромастоидальным подходом в положении больного сидя с согнутой и повернутой в сторону хирургического вмешательства головой. Исходным местом роста для менингиом служили различные по протяженности участки твердой мозговой оболочки от верхушки до внутреннего слухового прохода пирамиды височной кости, а в 4 случаях зона роста распространялась на передне-латеральные отделы намета мозжечка вблизи его вырезки и в 3 – на скат черепа. Все невриномы исходили из вестибулокохлеарного нерва и для удаления опухоли из внутреннего слухового прохода производилась задняя меатотомия. Во всех случаях неврином и менингиом мостомозжечкового угла опухолевая ткань была удалена полностью. Тотальное удаление новообразований подтверждено у этих больных с помощью МРТ, не выявившей контрастирования остаточной опухоли. Эпидермоиды полностью удалены у 5 пациентов, а у 1 выявлены незначительные по объему остатки опухоли в области контралатерального мостомозжечкового угла. Летальных исходов после хирургических вмешательств не наблюдалось. Постоперационный асептический менингит у 1 больного с эпидермоидом успешно излечен кратким курсом гормональной терапии. У 2 пациентов с эпидермоидными опухолями отмечено возникновение транзиторных изолированных парезов глазодвигательного (1 случай) и отводящего (1 случай) нервов. Эти нарушения регрессировали в течение 3 и 4 недель соответственно, и наиболее вероятными причинами развития этих преходящих неврологических осложнений являются интраоперационная тракция нервных корешков и спазм тонких ветвей базилярной артерии, выделяемых из толщи эпидермоидной опухоли. В 1 случае менингиомы верхушки пирамиды височной кости удаление супратенториальной части опухоли привело к развитию изолированного пареза глазодвигательного нерва. Глазодвигательный нерв, растянутый на верхнем полюсе опухоли был выделен и анатомически сохранен, а полное восстановление его функций отмечено в течение последующих 2 месяцев. При тотальном удалении неврином вестибулокохлеарного нерва сохранена анатомическая целостность лицевого нерва во всех случаях, и восстановление функций мимических мышц наблюдалось в течение 2 – 3 месяцев послеоперационного периода. Основной целью хирургических вмешательств было удаление опухолей мостомозжечкового угла, а для выявления и устранения возможной васкулярной причины тригеминальной невралгии проводился тщательный осмотр входной зоны корешка тройничного нерва. Микрохирургические эксплорации мостомозжечкового угла выявили различные типы анатомо-топографических взаимоотношений между опухолью, входной зоной корешка тройничного нерва в ствол головного мозга и сосудистыми образованиями. Обнаруженные нами разнообразные варианты прямого и опосредованного через васкулярные образования компрессионного воздействия опухолевых узлов на тригеминальную входную зону схематически подразделены на пять типов (рис. 1).
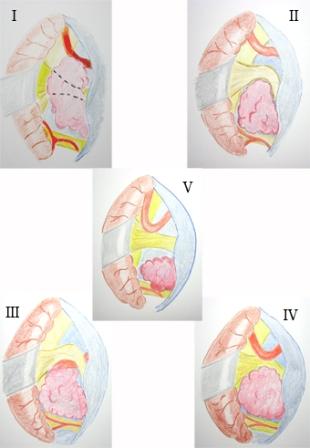
Рис. 1. Схема различных видов топографических взаимотношений (опухоль, корешок тройничного нерва, сосудистая структура)
Предлагаемые топографические варианты соотношений опухоль – корешок тройничного нерва – сосудистая структура основаны на четырехступенчатой схеме, разработанной H. Kobata и соавт. [18] для эпидермоидов мостомозжечкового угла, сопровождающихся дисфункцией краниальных нервов.
Тип I – корешок тройничного нерва расположен внутри опухоли.
Тип II – опухоль сдавливает, смещает и деформирует корешок тройничного нерва, который расположен на поверхности опухолевого узла и не контактирует с сосудами.
Тип III – корешок тройничного нерва смещен и сдавлен артериальным сосудом, дислоцированным опухолевым узлом.
Тип IV – корешок тройничного нерва сдавлен между опухолью и артериальным сосудом.
Тип V – корешок тройничного нерва не соприкасается или минимально контактирует с опухолью без смещения и деформации нервных волокон.
В анализируемой серии пациентов компрессионные воздействия на корешок тройничного нерва, соответственно представленным топографическим типам, распределились следующим образом: тип I у 3 пациентов, тип II – у 11, тип III – у 2, тип IV – у 4 и тип V – у 1 больной. Оперативное вмешательство ограничивалось удалением опухолей у пациентов с топографическими взаимоотношениями, соответствующим типам I и II, а при III, IV и V типах дополнительно проводилась сосудистая декомпрессия корешка тройничного нерва. Смещения и деформации корешка тройничного нерва опухолевыми узлами мостомозжечкового угла выявлены у 20 пациентов, а в 1 наблюдении непосредственного контакта корешка с новообразованием не отмечалось. Из 6 пациентов с эпидермоидами у 3 нервный корешок располагался в толще ткани новообразования (рис. 2), а у 3 – был растянут на задней поверхности опухолевого узла.
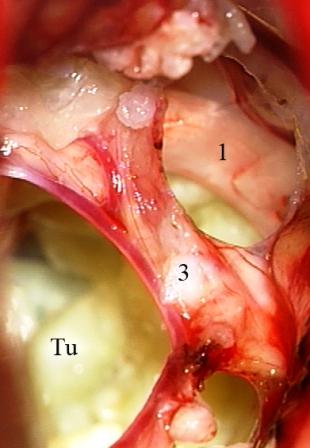
Рис. 2. Этап удаления эпидермоида мостомозжечкового угла справа. Деформированные корешки тройничного и лицевого-вестибулокохлеарного нервов располагаются внутри опухолевой ткани.
У больных с менингиомами направление смещения нервного корешка зависело от исходного места роста опухоли. При локализации зоны роста в области верхушки пирамиды височной кости корешок тройничного нерва чаще располагался на задне-нижней поверхности опухолевого узла. В случаях менингиом, исходящих из твердой мозговой оболочки пирамиды височной кости кзади от вырезки Грубера, а также и при невриномах вестибулокохлеарного нерва, нервные волокна были смещены вперед, располагаясь на передне-верхней поверхности опухоли. Таким образом, среди 17 пациентов, у которых корешок тройничного нерва лежал непосредственно на поверхности опухоли, нервные волокна были смещены и деформированы верхними (9 случаев) и нижними (8 случаев) отделами новообразований. Для минимизации интраоперационной травматизации волокон тригеминального нерва опухоли уменьшались посредством интракапсулярной резекции, которая при менингиомах сочеталась с поэтапной деваскуляризацией. Используемая тактика позволяла всегда четко идентифицировать плоскость арахноидальной диссекции между нервными волокнами и прогрессивно уменьшающейся опухолью. После удаления опухолей оценивались взаимоотношения входной зоны корешка тройничного нерва и расположенных вблизи нее сосудистых структур для определения целесообразности дальнейших оперативных манипуляций. Если смещенные опухолью мозжечковые артерии и их ветви фиксированы сращениями паутинной оболочки вдали от корешка тройничного нерва, входная зона которого не имеет признаков перекрестного сдавления, то оперативное вмешательство ограничивалось удалением опухоли без дополнительных хирургических манипуляций (рис. 3).
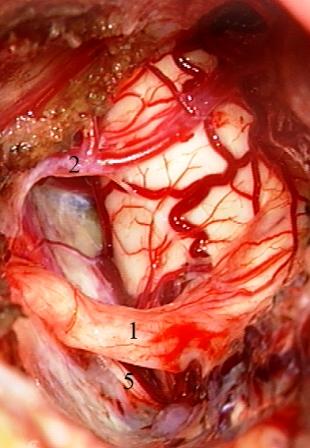
Рис. 3. Менингиома пирамидно-тенториального угла слева. После удаления опухоли смещенный вниз корешок тройничного нерва не контактирует с верхней мозжечковой артерией.
Вблизи тригеминальной входной зоны после удаления опухоли могут располагаться петли артериальных сосудов, идущих рядом и вдоль нервных волокон, но не оказывающих компрессионного перекрестного воздействия на корешок. В этих случаях, несмотря на близкое расположение нервных и сосудистых структур, иногда сопровождающееся их контактом, проведение нейроваскулярной декомпрессии не является обоснованным (рис. 4).
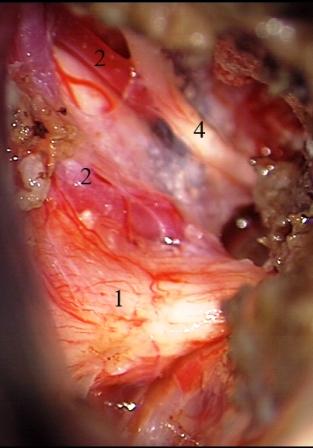
Рис. 4. Менингиома верхушки пирамиды височной кости справа. Каудальная вервь верхней мозжечковой артерии прилежит к верхнему краю корешка тройничного нерва, не оказывая перекрестного компрессионного воздействия.
На начальных этапах оперативного вмешательства выявить наличие нейроваскулярного конфликта часто не представляется возможным из-за тесного прилежания корешка тройничного нерва к деформированному опухолевым узлом стволу головного мозга и сложности идентификации прикрытых тканью новообразования сосудистых структур. Наличие нейроваскулярного конфликта сравнительно легко подтверждается при относительно небольших по размеру опухолях в области верхушки пирамиды височной кости. Верхняя мозжечковая артерия и ее ветви, смещаемые каудальными отделами опухоли назад и вниз, внедряются в тригеминальную входную зону (топографический тип III), что обнаруживается на ранних этапах хирургического вмешательства (рис. 5).
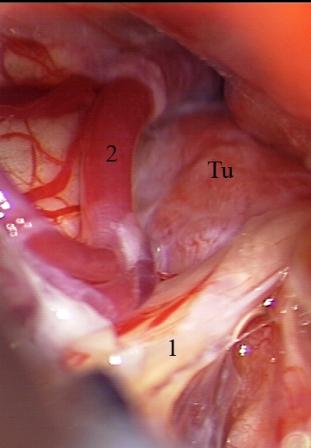

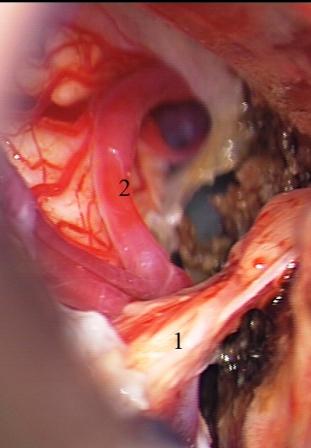
Рис. 5 (а, б, в) Менингиома верхушки пирамиды височной кости справа. а - перекрестная компрессия выходной зоны корешка тройничного нерва смещенной опухолью верхней мозжечковой артерией, б - сохранение нейроваскулярного конфликта после удаления опухоли, в - верхняя мозжечковая артерия выведена из выходной зоны корешка тройничного нерва и фиксирована мышечной тканью.
Постепенное уменьшение размеров опухоли и последующее ее удаление создает возможность для четкой визуализации верхней и передней нижней мозжечковых артерий, расположенных вблизи тригеминальной входной зоны. Микроваскулярная декомпрессия, производимая после удаления опухолей мостомозжечкового угла, характеризуется некоторыми специфическими особенностями. Нейроваскулярный конфликт может быть устранен двумя разными способами, и выбор более адекватной техники оперативного вмешательства зависит от степени растяжения и деформации корешка тройничного нерва. Первый способ, представляющий собой традиционную технику микроваскулярной декомпрессии и заключающийся в выделении и перемещении петли сдавливающего сосуда в сторону от тригеминальной входной зоны с установкой мягкого импланта (мышечная или жировая ткань) между стволом головного мозга, нервным корешком и сосудистой структурой, использован у большинства пациентов с васкулярной компрессией после удаления опухолей. Эта методика применялась при относительно незначительной деформации и растяжении волокон корешка тройничного нерва, когда нейроваскулярный конфликт визуализируется во время удаления опухолевого узла (рис. 6).
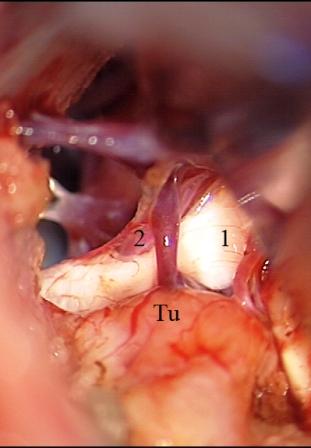
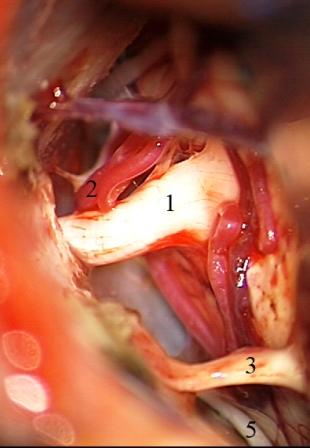
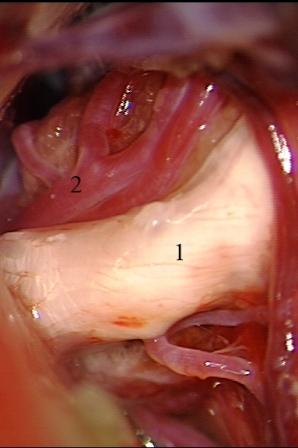
Рис. 6 (а, б, в). Невринома вестибулокохлеарного нерва слева. а - во время резекции опухоли обнажен корешок тройничного нерва, сдавленный верхней мозжечковой артерией, б - после тотального удаления невриномы четко визуализирован нейроваскулярный конфликт, в - окончательный вид нейроваскулярной декомпрессии
Смещенный и деформированный корешок тройничного нерва иногда остается фиксированным к стволу головного мозга арахноидальными сращениями, и возникает необходимость в проведении дальнейшей диссекции для полноценной визуализации парастволовых отделов нервного корешка и выявления сосудистой компрессии (рис. 7).
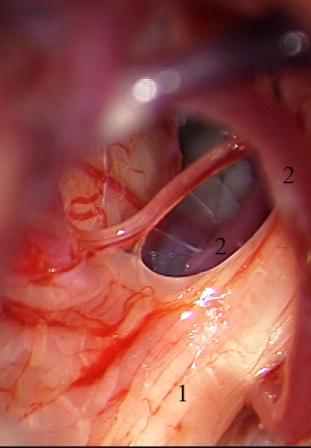
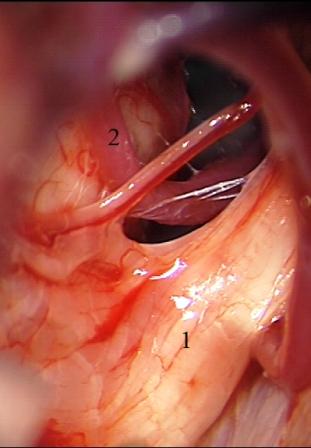
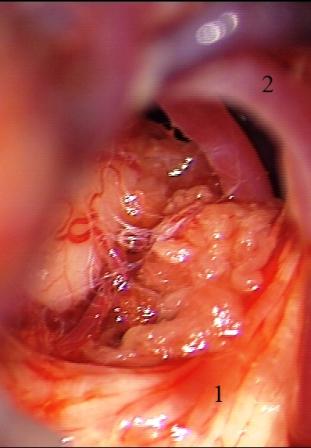
Рис. 7 (а, б, в). Невринома вестибулокохлеарного нерва справа. а - смещенный вверх и вперед корешок тройничного нерва после удаления невриномы, б - верхняя мозжечковая артерия выведена из выходной зоны корешка тройничного нерва, в - корешок тройничного нерва изолирован от верхней мозжечковой артерии мышечной тканью.
Второй способ нейроваскулярной декомпрессии может быть использован только в случаях значительного растяжения нервных волокон корешка, расположенного между опухолью и артериальным сосудом (топографический вариант IV). Нейроваскулярный конфликт в этих наблюдениях устраняется путем мобилизации нервного корешка, который после пересечения арахноидальных сращений со стволом головного мозга свободно провисает и более не контактирует с артериальным сосудом, что не требует установки имплантов для фиксации нервных и сосудистых структур (рис. 8).
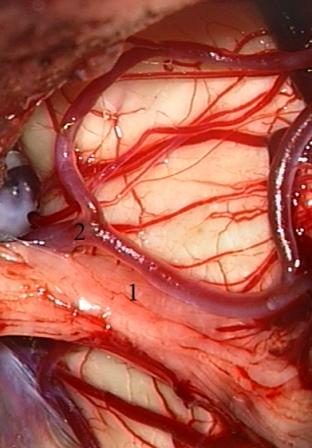
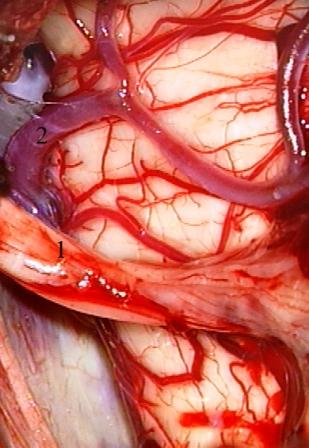
Рис. 8 (а, б) Менингиома пирамиды височной кости слева. а - после удаления опухоли корешок тройничного нерва распластан на деформированном стволе головного мозга и сдавлен верхней мозжечковой артерией, б - в результате диссекции корешок тройничного нерва свободно провисает с исчезновением нейроваскулярного конфликта.
Сосудистая компрессия была выявлена и устранена у 7 пациентов. Сдавление корешка тройничного нерва верхней мозжечковой артерией и ее ветвями было обнаружено в 6 наблюдениях (2 невриномы и 4 менингиомы) и латеральной веной моста в 1 случае (менингиома). Артериальные петли выделялись из паутинной оболочки и отводились от тригеминальной входной зоны, а последующая фиксация нового пространственного положения достигалась установкой небольших (2-4 мм) кусочков мышечной или фасциально-жировой тканей. Исчезновение клинических проявлений тригеминальной невралгии в послеоперационном периоде наблюдалось у всех пациентов. В 7 случаях также отмечено усиление степени имевшейся ранее гипестезии или возникновение дополнительных областей снижения чувствительности в зоне иннервации тройничного нерва. Эти сенсорные нарушения постепенно регрессировали, и восстановление чувствительности не сопровождалось повторным возникновением лицевой боли. У 5 пациентов, ранее не подвергавшихся хирургическим манипуляциям на периферических нервах и имеющих сенсорные выпадения, обнаружено улучшение чувствительности на лице после удаления опухолей мостомозжечкового угла.
Обсуждение. Среди пациентов, которым проводились открытые хирургические вмешательства на корешке тройничного нерва для лечения синдрома тригеминальной невралгии, частота новообразований мостомозжечкового угла значительно варьирует, колеблясь от 0.9% до 9.9% [8, 11 – 13, 18, 27]. В представленной серии пациентов частота опухолей составила 10% от всех больных с тригеминальной невралгией, подвергшихся хирургической эксплорации мостомозжечкового угла. Приведенные литературные и собственные данные не отображают действительное число опухолевых поражений мостомозжечкового угла при синдроме тригеминальной невралгии. В клинической практике определенная часть пациентов с успехом подвергаются другим хирургическим методикам, таким как деструкции периферических ветвей тройничного нерва, пункционная тригеминальная ризотомия и стереотаксическая радиохирургия. С учетом большого числа пациентов с хорошо контролируемым с помощью лекарственной терапии болевым синдромом, истинная встречаемость опухолей становится значительно ниже. Синдром тригеминальной невралгии наблюдается с различной частотой при разных по гистологическому типу опухолях мостомозжечкового угла. Анализ хирургического опыта W. E. Dandy, основанного на результатах лечения 186 случаев опухолей мостомозжечкового угла, показал, что невралгия тройничного нерва наблюдалась в 16,7% случаев, причем частота ее варьировала при различных по гистологическому типу опухолях и составила при невриномах - 10% (16/160), менингиомах - 38.5% (5/13) и эпидермоидах - 76.9% (10/13) [30]. Столь высокая встречаемость лицевой боли среди опухолей мостомозжечкового угла была обусловлена профессиональными интересами W. E. Dandy и соответствующей концентрацией пациентов с тригеминальной невралгией в Johns Hopkins Hospital. Синдром тригеминальной невралгии возникает нечасто и по данным A. Puca и соавт. [27] отмечался всего в 9 из 73 наблюдений с новообразованиями мостомозжечкового угла. Невралгия тройничного нерва сопровождает невриномы вестибулокохлеарного нерва в 3.3% случаев и, обычно, наблюдается при опухолях больших размеров [21, 28, 33]. При эпидермоидах мостомозжечкового угла тригеминальная невралгия в среднем обнаруживается у 29.7% пациентов, а по частоте этот симптом уступает только нарушениям слуха, выявляемым в 37,6% наблюдений [18, 35]. Среди 232 наблюдений тригеминальной невралгии с опухолями мостомозжечкового угла, собранных из опубликованных ранее нескольких серий пациентов, F. G. Barker и соавт. обнаружили менингиомы, невриномы и эпидермоиды соответственно в 40%, 22% и 38% случаях [8]. По данным H. Kobata и соавт. среди 515 больных с тригеминальной невралгией, подвергнутых эксплорации мостомозжечкового угла, у 51 (9.9%) пациентов имелись опухолевые поражения, причем менингиомы выявлены в 16, невриномы – в 7 и эпидермоиды – в 28 случаях [18]. Похожее преобладание менингиом и эпидермоидов отмечается в представленной нами группе пациентов. Клинические проявления синдрома тригеминальной невралгии при опухолях мостомозжечкового угла не имеют существенных отличий от таковых при нейроваскулярной компрессии [3, 8, 9, 18, 22, 24, 32]. Дополнительные неврологические проявления вследствие поражения других краниальных нервов и ствола головного мозга, развивающиеся параллельно или позднее манифестации невралгического синдрома, могут указывать на наличие новообразований мостомозжечкового угла. Сравнительно раннее возникновение невралгии тройничного нерва в молодом возрасте (в среднем 31 год) является отличительной чертой эпидермоидов мостомозжечкового угла [18, 24, 29, 30, 35]. Характерным для эпидермоидов также является длительный период от манифестации тригеминальной невралгии до выявления самой опухоли с помощью КТ или МРТ. Указанные особенности обусловлены медленным ростом эпидермоидных опухолей по сравнению с менингиомами и невриномами, и вследствие этого поздним возникновением дополнительных неврологических проявлений, указывающих на опухолевую природу клинической картины. Механизм возникновения невралгии тройничного нерва при опухолях мостомозжечкового угла длительное время был предметом обсуждения, оставаясь неопределенным и в настоящее время. W. E. Dandy в качестве причины лицевой невралгии рассматривал контакт между опухолью и нервным корешком и отметил более частое возникновение тригеминальной невралгии при небольших по размеру новообразованиях, соприкасающихся с нервным корешком, и редкие случаи невралгического синдрома при крупных опухолях, приводящих к выраженной деформации нервных волокон [12]. В большинстве наблюдений компрессия и деформация корешка тройничного нерва при опухолях мостомозжечкового угла проявляются сенсорными и, реже, моторными тригеминальными нарушениями. Однако остается необъяснимым тот факт, что при опухолях мостомозжечкового угла сдавление корешка тройничного нерва наблюдается значительно чаще, чем синдром тригеминальной невралгии. Деформация и растяжение корешка тройничного нерва медленно растущим новообразованием сопровождается тригеминальной невралгией, и в представленной серии пациентов причиной лицевой боли у 14 больных служило непосредственное опухолевое воздействие. Направление смещения корешка тройничного нерва опухолевым узлом не имеет четкой связи с развитием невралгического синдрома, что достоверно иллюстрируется различным расположением нервных волокон по отношению к опухолевым узлам у оперированных нами больных. Следует отметить, что среди 91 петрокливальных менингиом S. Ishimura и соавт. показали преобладание тригеминальной невралгии при задне-нижней дислокации корешка тройничного нерва, вызванной опухолями верхушки пирамиды височной кости [15]. Вследствие смещения и деформации ствола головного мозга, корешка тройничного нерва и прилежащих сосудистых структур достоверное подтверждение с помощью МРТ нейроваскулярного конфликта как причины тригеминальной невралгии при опухолях мостомозжечкового угла невозможно. МРТ признаки нейроваскулярной компрессии обнаруживаются при небольших опухолях (до 1 – 1,5 см), не вызывающих деформации ствола головного мозга, так как малые размеры новообразований позволяют рассмотреть входную зону корешка тройничного нерва с прилежащими к ней сосудами [23]. В подобных условиях дооперационной неопределенности хирургическое вмешательство при сочетании тригеминальной невралгии с опухолью мостомозжечкового угла является окончательной диагностической процедурой, направленной на оценку нейрососудистых взаимоотношений входной зоны корешка тройничного нерва. Удаление опухолевых масс мостомозжечкового угла с декомпрессией корешка тройничного нерва обычно приводит к устранению тригеминальной невралгии. Исчезновение пароксизмальной лицевой боли может происходить вследствие неизбежной микротравматизации нервных волокон и тонких сосудов корешка тройничного нерва во время диссекции опухоли. Повреждение нервных волокон приводит к денервации определенной области лица, и болевой синдром подвергается регрессу на фоне возникшего после операции нарушения чувствительности различной степени выраженности. Однако этот возможный механизм устранения невралгии тройничного нерва подразумевает, что по мере восстановления чувствительности у значительного числа пациентов должен наступать рецидив болевого синдрома, как это наблюдается после пункционной парциальной тригеминальной ризотомии. Вследствие того, что после удаления опухолей мостомозжечкового угла в большинстве случаев тригеминальная невралгия не рецидивирует в отдаленном послеоперационном периоде, микротравматизации волокон корешка в качестве важного условия устранения пароксизмальной боли не следует придавать особое значение.
Другой механизм регресса невралгии тройничного нерва обусловлен устранением натяжения и деформации волокон корешка тройничного нерва в результате тотального или парциального удаления опухоли. Следует отметить, что во время хирургического вмешательства должны быть пересечены арахноидальные сращения, фиксирующие корешок тройничного нерва к стволу мозга. Особенно важно произвести полноценную микрохирургическую декомпрессию в процессе резекции эпидермоидов, что иногда требует удаления сращенной с тригеминальной входной зоной тонкой капсулы опухоли. Согласно P. J. Jannetta васкулярная компрессия корешка тройничного нерва является основным этиологическим фактором тригеминальной невралгии и в случаях опухолей мостомозжечкового угла [8]. Сосудистое сдавление в серии P. J. Jannetta было выявлено у 21 из 26 пациентов с тригеминальной невралгией и опухолями мостомозжечкового угла, а в серии эпидермоидов H. Kobata и соавт. подтвердили наличие нейроваскулярного конфликта в каждом третьем наблюдении [18]. В этих случаях опухоль смещает сосудистую структуру в тригеминальную входную зону (топографический тип III) или корешок тройничного нерва смещается опухолевым узлом к «нормально» расположенному сосуду (топографический тип IV), что приводит к возникновению нейроваскулярного конфликта. Клинические наблюдения, подтверждающие указанное выше положение, представлены некоторыми авторами при опухолях различной гистологической структуры [8, 14, 18, 19, 23, 33, 34]. В оперированной нами группе больных васкулярная компрессия обнаружена при менингиомах и невриномах, а у пациентов с эпидермоидами нейроваскулярный конфликт отсутствовал. Анализ собственных результатов и литературных данных показал, что четкой взаимосвязи между размерами опухоли мостомозжечкового угла, опухолевой и/или сосудистой компрессией корешка тройничного нерва и синдромом тригеминальной невралгии не существует. Однако представляется вполне обоснованным, что крупные опухоли сопровождаются невралгией тройничного нерва, развивающейся из-за выраженной деформации и растяжения тригеминальной входной зоны. Наш клинический опыт показал, что во всех наблюдениях с исключительно опухолевой природой невралгии тройничного нерва (топографические типы I и II) размеры новообразований были значительными (более 3 см). Опухоли сравнительно меньшего диаметра могут вызывать лицевую невралгию вследствие смещения, как сосудов, так и нервного корешка (топографические типы III и IV), что приводит к возникновению нейроваскулярного конфликта. В представленной нами группе пациентов с нейроваскулярным конфликтом только у 3 из 7 выявлена небольшая по протяженности (до 2 см) опухоль мостомозжечкового угла. Следует особо подчеркнуть, что выявляемое во время хирургического вмешательства отсутствие компрессионного воздействия опухоли на корешок тройничного нерва (топографический тип V) указывает на высокую вероятность существования нейроваскулярного конфликта. Таким образом, невралгия тройничного нерва может быть обусловлена нейроваскулярным конфликтом не только при малых по размеру, но и больших опухолях мостомозжечкового угла.
Это положение обосновывает необходимость обязательной и тщательной микрохирургической эксплорации зоны входа корешка тройничного нерва в ствол головного мозга при сочетании невралгии тройничного нерва и опухоли мостомозжечкового угла для проведения васкулярной декомпрессии нервного корешка и устранения пароксизмальной лицевой боли.
ЛИТЕРАТУРА
-
Григорян Ю. А. Микрохирургическая сосудистая декомпрессия корешка тройничного нерва при тригеминальной невралгии // Пробл. нейростоматол. и стоматол. – 1997. – N 1. – С. 45 – 49.
-
Григорян Ю. А., Истомин А. А. Структурные изменения корешка тройничного нерва при тригеминальной невралгии // Пробл. стоматол. и нейростоматол. – 1999. – N 3. – С. 31 – 36.
-
Григорян Ю. А., Оглезнев К. Я., Рощина Н. А. Этиологические факторы синдрома тригеминальной невралгии // Журн. невролог. и психиатр. – 1994. – N 6. – С. 18 – 22.
-
Коновалов А.Н., Махмудов У.Б., Шиманский В.Н., Таняшин С.В., Отарашвили И.А., Пронин И.Н., Лебедева М.А., Орлова О.Р., Мингазова Л.Р. Васкулярная декомпрессия в лечении невралгии тройничного нерва // Вопр. нейрохир. – 2008. – N 3. – С. 3 – 8.
-
Оглезнев К. Я., Григорян Ю. А. Микроваскулярная декомпрессия тригеминального корешка при невралгии тройничного нерва // Вопр. нейрохир. – 1991. – N 1. – С. 22 – 24.
-
Оглезнев К. Я., Григорян Ю.А., Шестериков С.А. Патофизиологические механизмы возникновения и методы лечения лицевых болей // Наука, Новосибирск – 1990. – 190 с.
-
Шулев Ю.А., Гордиенко К.С., Посохина О.В. Микроваскулярная декомпрессия в лечении тригеминальной невралгии // Нейрохирургия. – 2004. – N 2. – С. 7 – 14.
-
Barker F. G., Jannetta P. J., Babu R. P., Pomonis S., Bissonette D. J., Jho H. D. Long-term outcome after operation for trigeminal neuralgia in patients with posterior fossa tumors // J. Neurosurg. – 1996. – Vol. 84, N 5, - P. 818 – 825.
-
Bullit E., Tew J. M., Boyd J. Intracranial tumors in patients with facial pain // J. Neurosurg. – 1986. – Vol. 64, N 6. - P. 865 – 871.
-
Celik S. E., Kocaeli H., Cordan T., Bekar A. Trigeminal neuralgia due to cerebellopontine angle lipoma // J. Neurosurg. – 2000. – V. 92, N 5. – P. 889.
-
Cheng T. M. W., Cascino T. L., Onofrio D. M. Comprehensive study of diagnosis and treatment of trigeminal neuralgia secondary to tumors // Neurology. – 1993. – Vol. 43, N 11. – P. 2298 – 2302.
-
Dandy W. E. Concerning the cause of trigeminal neuralgia // Am. J. Surg. – 1934. – V. 24. – P. 447 – 454.
-
Hamada S., Asahara H., Fukusima T. Trigeminal neuralgia caused by brain tumors: study of 125 cases // Masui. – 1988. – Vol. 37, N 8. – P. 1002 – 1006.
-
Hasegawa K., Kondo A., Kinuta Y., Tanabe H., Kawakami M., Matsuura N., Chin M., Saiki M. Studies concerning the pathogenesis of trigeminal neuralgia caused by cerebellopontine angle tumors // No Shinkei Geka. – 1995. – Vol. 23, N 4. – P. 315 – 320.
-
Ishimura S., Kawase T., Onozuka S., Yoshida K., Ohira T. Four subtypes of petroclival meningiomas: differences in symptoms and operative findings using the anterior transpetrosal approach // Acta neurochir. (Wienn). – 2008. – Vol. 150, N 7. – P. 637 – 645.
-
Jamjoom A. B., Jamjoom Z. A.B., Al-Fehaily M., El-Watidy S., Al-Moallem M., Nair-Ur-Rahman. Trigeminal neuralgia related to cerebellopontine angle tumors // Neurosurg. Rev. – 1996. – Vol. 19, N 4. – P. 237 – 241.
-
Jannetta P. J. Microvascular decompression of the trigeminal nerve root entry zone // Trigeminal Neuralgia / Eds. R. L. Rovit, R. Murali, P. J. Jannetta. – Baltimore: Williams &Wilkins, 1990. – P. 201 – 222.
-
Kobata H., Kondo A., Iwasaki K. Cerebellopontine angle epidermoids presenting with cranial nerve hyperactive dysfunction: pathogenesis and long-term surgical results in 30 patients // Neurosurgery. – 2002. – Vol. 50, N 2. – P. 276 – 286.
-
Kuroki A., Kayama T., Song J., Saito S. Removal of petrous apex meningioma and microvascular decompression for trigeminal neuralgia through the anterior petrosal approach. Case report // Neurol. Med. Chir. (Tokyo). – 1999. – Vol. 39, N 6. – P. 447 – 451.
-
Liang J., Li Q., Liu G. Removing the tumor of the cerebellopontine angle with microsurgery to treat the secondary trigeminal neuralgia // Lin. Chuang. Er. Bi. Yan. Hou. Kee. Za. Zhi. – 2005. – Vol. 19, N 10. – P. 446 – 448.
-
Matsuka Y., Fort E. T., Merrill R. L. Trigeminal neuralgia due to an acoustic neuroma in the cerebellopontine angle // J. Orofac. Pain. – 2000. – V. 14, N 2. – P. 147 – 151.
-
Meng L., Yuguang L., Feng., Wandong S., Shugan Z., Chengvuan W. Cerebellopontine angle epidermoids presenting with trigeminal neuralgia // J. Clin. Neurosci. – 2005. – Vol. 12, N 7. – P. 784 – 786.
-
Miller J. P., Acar F., Burchiel K. J. Trigeminal neuralgia and vascular compression in patients with trigeminal schwannomas: case report // Neurosurgery. – 2008. – Vol. 62, N 4. – P. 974 – 975.
-
Ogleznev K. Y., Grigoryan Yu. A., Slavin K. V. Parapontine epidermoid tumours presenting as trigeminal neuralgias: anatomical findings and operative results // Acta neurochir. (Wienn). – 1991. – Vol. 110, N 3-4. – P.116 – 119.
-
Perrini P., Rasile F., Leggate J. Trigeminal neuralgia as initial symptom of paramedian tentorial meningioma // Neurol. Sci. – 2009. – Vol. 30, N 1. – P. 81 – 83.
-
Puca A., Meglio M. Typical trigeminal neuralgia associated with posterior cranial fossae tumors // Ital. J. Neurol. Sci. – 1993. – Vol. 14, N 7. – P. 549 – 552.
-
Puca A., Meglio M., Tamburrini G., Vari R. Trigeminal involvement in intracranial tumours. Anatomical and clinical observations on 73 patients // Acta neurochir. (Wienn). – 1993. – Vol. 125, N 1-4. – P. 47 – 51.
-
Pyen J.-S., Whang K., Hu C., Hong S.-K., Lee M.-S., Lee J.-Y., Hong S.-W. Tic convulsive caused by cerebellopontine angle schwannoma // Yonsei Med. J. – 2001. – V. 42, N 2. – P. 255 – 257.
-
Revilla A. G. Tic douloureux and its relationship to tumors of the posterior fossa: analysis of twenty-four cases // J. Neurosurg. – 1947. – Vol. 4, N 3. – P. 233 – 239.
-
Revilla A.G. Differential diagnosis of tumors at the cerebellopontine recess // Bull. Johns Hopkins Hosp. – 1948. – V.80. – P. 187 – 212.
-
Ruelle A., Datti R., Andrioli G. Cerebellopontine angle osteoma causing trigeminal neutalgia: case report // Neurosurgery. – 1994. – Vol. 35, N 6, - P. 1135 – 1137.
-
Sakamoto E., Shiiba S., Sakamoto K., Matsumoto Y., Yoshida M., Hagiwara S., Kawahara H., Nakanishi O. Does trigeminal neuralgia due to intracranial tumor induce hypoesthesia? – Study of the quantitative sensory testing on seven cases of trigeminal neuralgia due to intracranial tumor // Pain Res. – 2005. – Vol. 20, N 1. – P. 9 – 14.
-
Samii M., Matthies C. Acoustic neurinomas associated with vascular compression syndromes // Acta neurochir. (Wienn). – 1995. – Vol. 134, N 3 – 4. – P. 148 – 154.
-
Samii M., Rosahl S. K., Tatagiba M. S. Microsurgical removal of a petrous apex meningioma after stereotactic radiation: technical case report // Neurosurgery. – 2001. – V. 49, N 1. – P. 216 – 220.
-
Samii M., Tatagiba M., Piquer J., Carvalho G. A. Surgical treatment of epidermoid cysts of the cerebellopontine angle // J. Neurosurg. – 1996. – Vol. 84, N 1. – P. 14 – 19.
Опубликовано в "Российском нейрохирургическом журнале имени профессора А.Л. Поленова", том II, № 1, 2010. с 28 - 41.