CIRUGÍA PARA UN LESIONAL EPYLEPSY EN ADULTOS
A. R. Sitnikov, Yu. A. Grigoryan, L. P. Mishnyakova
Keywords: epilepsy, focal cortical dysplasia, topectomy, gray matter heterotopia, focal pachygyria
Objetivo: mostrar los resultados de cirugía de epilepsia lesional en pacientes adultos con dysgenesias cortical.
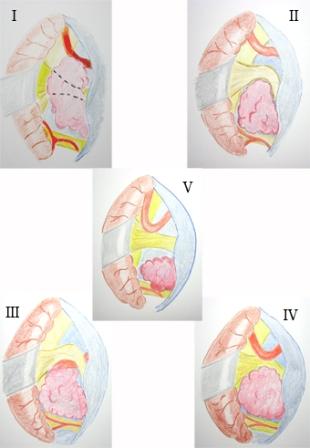
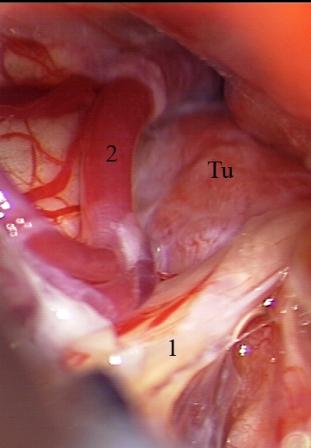
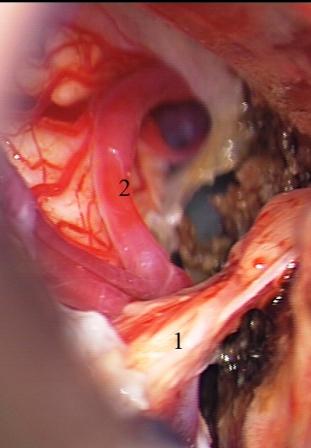
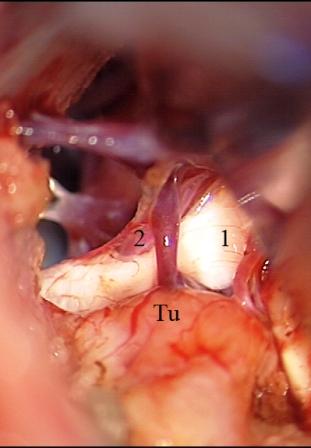
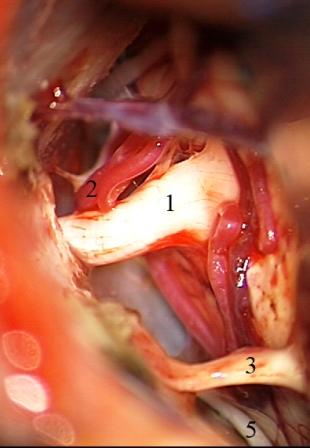
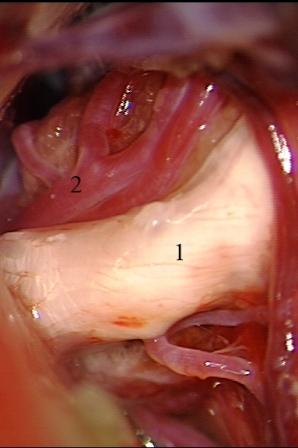
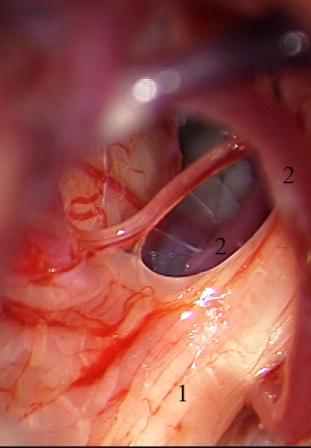
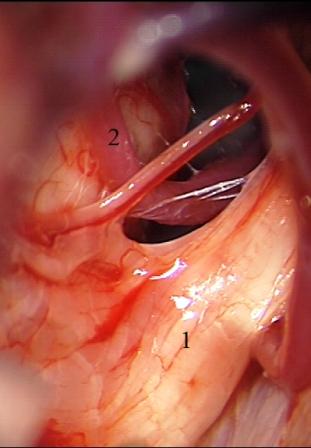
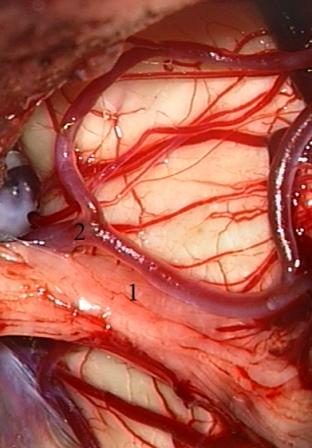
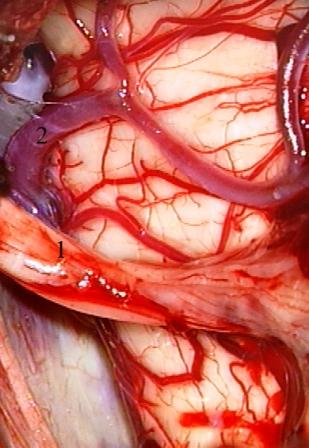
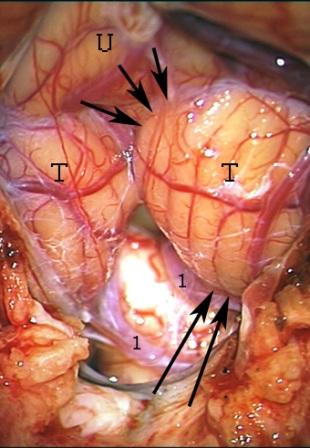
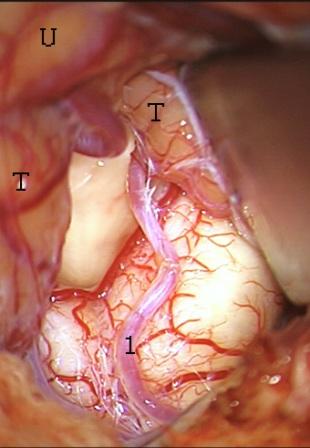
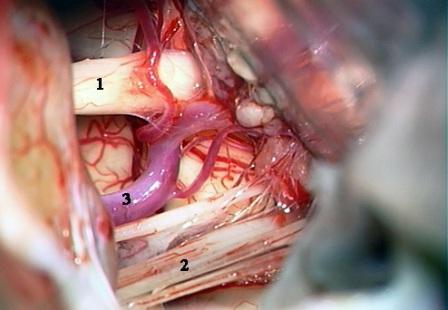
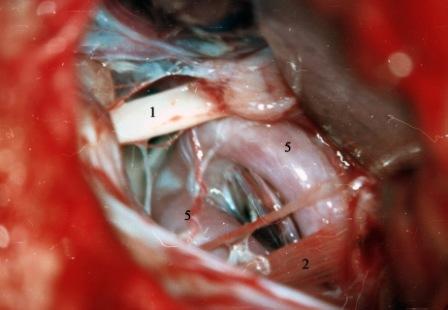
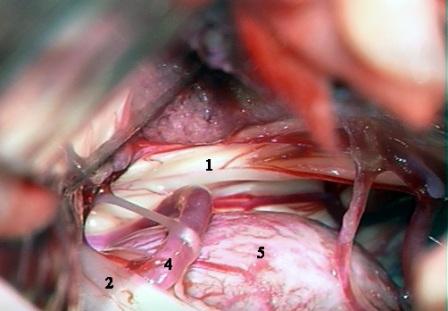
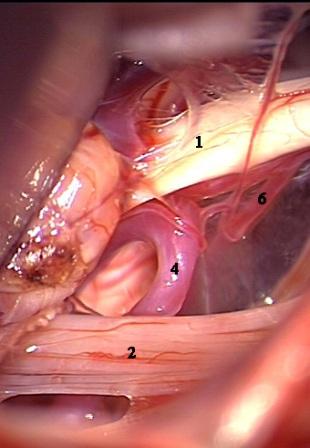
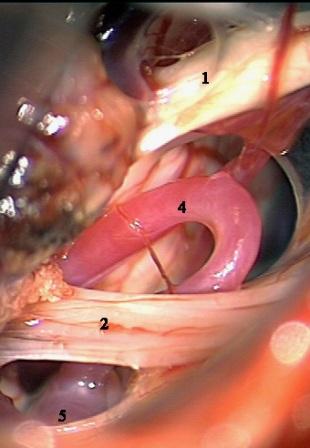
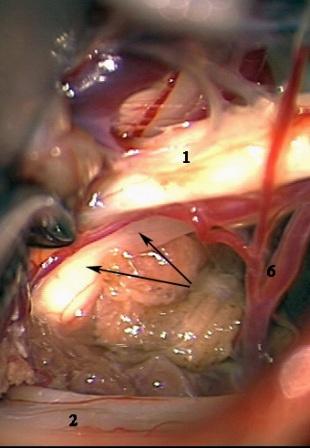
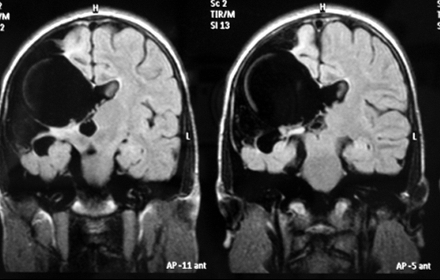
Método: 340 pacientes con la epilepsia se sometieron a la evaluación estándar incluso MRI, vídeo-EEG y fMRI. 12 pacientes han tenido la epilepsia debido a dysgenesias cortical y han sido hechos funcionar. El topectomy fue hecho en todos los casos usando el neuronavigation y evaluación neurophysiological intravigente.
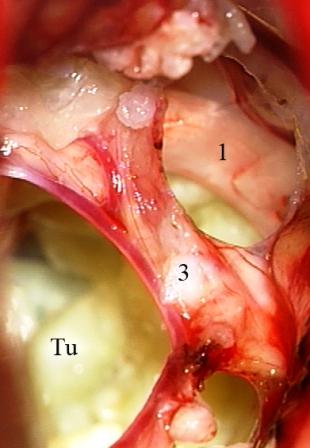
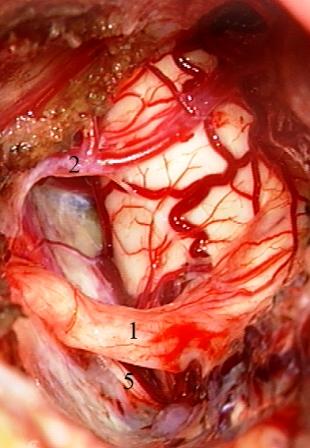
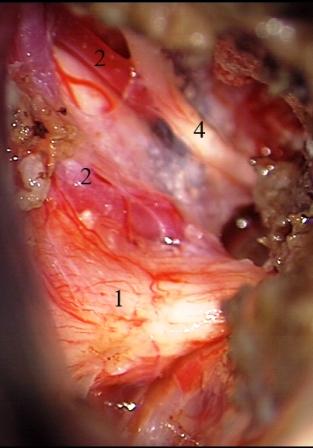
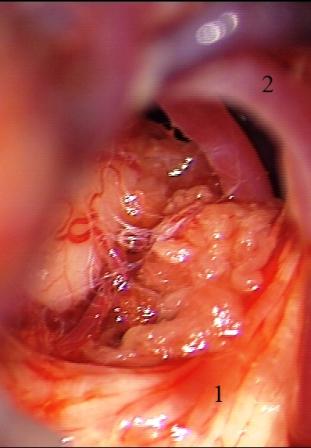
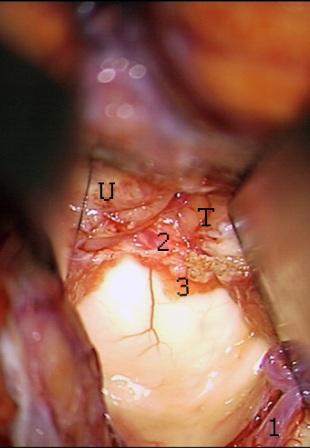
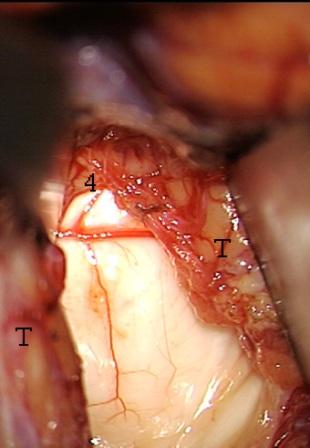
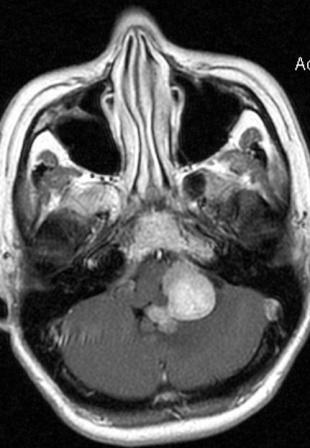
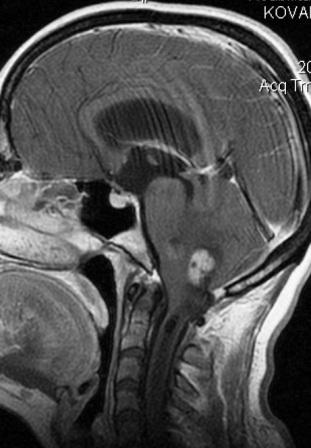
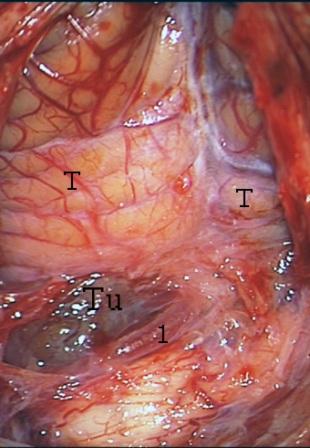
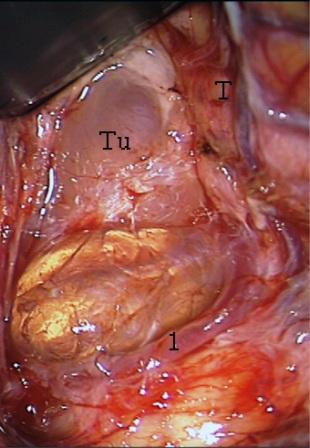
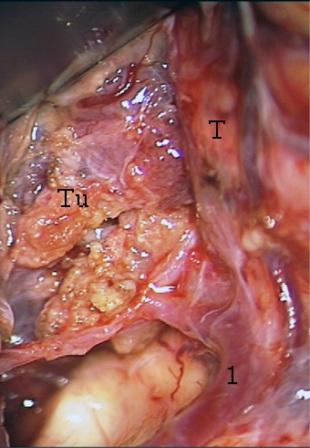
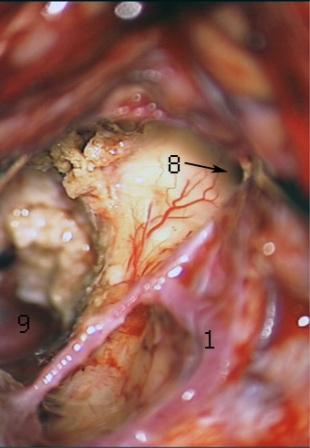
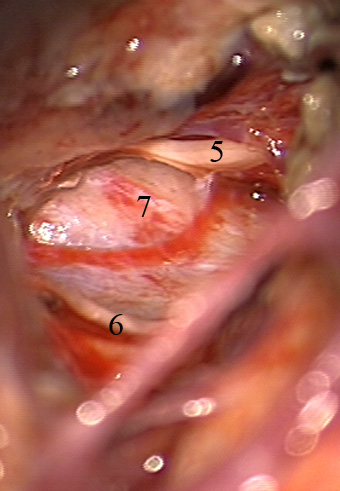
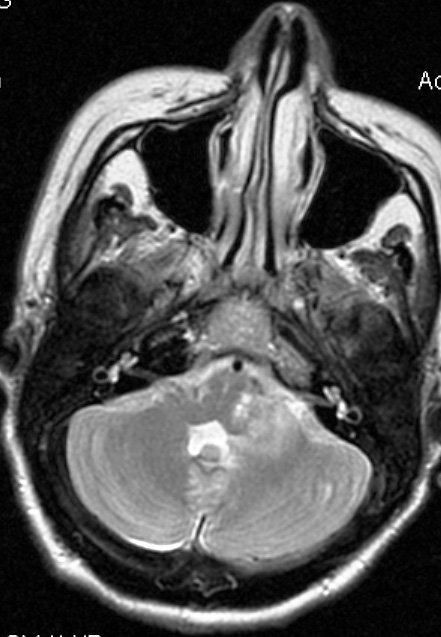
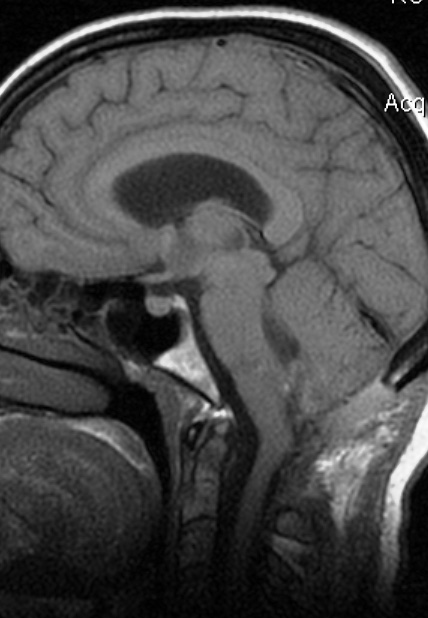
Resultados: la edad media de pacientes era 26 años (entre 17 y 33 años). La duración media de la enfermedad era 9.7 años. Había 7 mujeres y 5 varones. Todos los pacientes se sometieron a corticography invasivo antes de la resección quirúrgica para identificar la región epileptogenic que era resected después usando la navegación intravigente y corticography antes y después topectomy. En cinco casos un despierto-craniotomy bajo la anestesia local fue realizado para el paciente con dysgenesia localizado en áreas cerebrales elocuentes. No había ninguna complicación neurológica. El examen morfológico confirmó FCD que escribo a máquina en 4 casos, FCD IIa en 3 pacientes e IIb - en 3 pacientes, pachygyria focal en un caso y asunto de gris heterotopia en un caso. Tres años siguen – mostró un resultado sin asimiento completo en 6 pacientes (Engel Ia), 5 pacientes consiguieron a Engel II (asimientos parciales raros) y un paciente tiene el resultado de Engel III.
Conclusión: dysgenesia – las epilepsias asociadas en pacientes adultos pueden ser con éxito tratadas con topectomy sin la complicación neurológica usando neurophysiological intravigente escucha y despiertas - craniotomy de ser aplicable.
(In English)
Purpose: to show the results of surgical treatment of lesional epilepsy in adult patients with cortical dysgenesias.
Method: 340 patients with epilepsy underwent the standard evaluation including MRI, video-EEG and fMRI. 12 patients have had epilepsy due to cortical dysgenesias and have been operated. The topectomy was done in all cases using the neuronavigation and intra-operative neurophysiological assessment.
Results: The mean age of patients was 26 years (between 17 and 33 years). The mean duration of disease was 9.7 years. There were 7 females and 5 males. All patients underwent an invasive corticography before the surgical resection to identify the epileptogenic region which was resected afterwards using the intra-operative navigation and corticography before and after topectomy. In five cases an awake-craniotomy under the local anesthesia was performed for patient with dysgenesia located in eloquent brain areas. There was no neurological complication. The morphological examination confirmed FCD I type in 4 cases, FCD IIa in 3 patients and IIb –in 3 patients, focal pachygyria in one case and gray matter heterotopia in one case. The three-years follow – up showed a complete seizure-free outcome in 6 patients (Engel Ia), 5 patients achieved Engel II (rare partial seizures) and one patient has Engel III outcome.
Conclusion: dysgenesia – associated epilepsies in adult patients can be successfully treated with topectomy without neurological complication using the intra-operative neurophysiological monitoring and awake - craniotomy if applicable.
Опубликовано 6o Congreso Latinoamericano de Epilepsia, Cartagena 1st - 4th August
(6th Latin American Congress on Epilepsy), стр. 32.